近赤外光で神経活動を制御する “人工シナプス小胞”を開発
金沢大学ナノ生命科学研究所(WPI-NanoLSI)の新井敏教授、山崎健特任助教、サティア・サルケア・ランジャン特任助教(研究当時)、理工研究域生命理工学系の木矢剛智准教授、ならびに早稲田大学理工学術院総合研究所の宗慶太郎上級研究員(研究院教授)らの研究グループは、生体に優しい近赤外線レーザーを用いて、神経伝達を精密に操作できる「人工シナプス小胞」の開発に成功しました。
近年、薬剤投与において「どこに・いつ・どれだけ作用させるか」を制御することが極めて重要視されています。本研究グループは、操作性に優れた近赤外線レーザーにより局所的に温度を上昇させ、内包した薬剤を自在に放出できる人工小胞(リポソーム)を開発しました。このリポソームには、光エネルギーを効率的に熱へと変換する「光熱変換色素」が脂質二重膜内に組み込まれています。近赤外線レーザーを照射すると、この色素が超局所的に膜を加熱し、脂質膜の相状態(流動性)を瞬時に変化させることで、内包された薬剤が放出されます。すなわち、光を“スイッチ”としてナノスケールで薬剤放出を精密に制御することが可能となります。
さらに、この超局所的な加温技術により、従来の近赤外光を用いた技術で課題とされてきた正常組織や細胞への熱ダメージを大幅に低減できることも、本研究の大きなブレイクスルーの一つです。
本研究では、神経伝達物質であるアセチルコリンをリポソーム内に封入し、筋細胞およびショウジョウバエの脳に応用したところ、光照射によって神経活動を誘導することに成功しました。これは、生体内のシナプス伝達を模倣する「人工シナプス小胞」として機能することを示しており、今後、神経回路の解析や神経疾患モデルの研究への応用が期待されます。
本研究成果は、2025年7月27日、米国科学誌『ACS Nano』のオンライン版に掲載されました。
【研究の背景】
光を熱に変換する機能を持つ材料を生体内の特定部位に集積させ、操作性に優れたレーザーを照射して局所的に加温する医療技術は、「光温熱療法(Photothermal Therapy:PTT)」と呼ばれています。多くの場合、この手法には、生体組織の比較的深部まで到達可能な近赤外線領域の光が用いられます。近年では、光熱効果によって直接がん細胞を死滅させる方法に加えて、温度変化に応答して内包薬剤を徐放する粒子を利用したドラッグデリバリーシステム(DDS)への応用も進められています。特にDDS応用では、薬剤の放出と同時に熱ストレスを与えることができるため、がんの温熱治療において高い効果が報告されています。一方で、光温熱刺激によって薬剤を送達する場合、生体内には熱ストレスが好ましくない部位も存在します。そのため、近赤外線レーザーを用いた医療技術では、過度な加温が生じることが適用範囲を制限する要因となっており、重要な課題となっています。
【研究成果の概要】
本研究では、近赤外線レーザー照射時に周囲への熱影響を最小限に抑えつつ応答する、温度感受性ナノ粒子の開発に成功しました。まず、薬剤の運び手として、温度応答性脂質粒子(リポソーム)をカプセルとして採用しました。次に、光熱変換機能を持つ疎水性色素をリポソーム膜に埋め込むことで、光照射により超局所的に熱を発生させ、脂質膜を緩めて内包物を放出する仕組みを設計しました(図1)。材料の最適化の結果、主成分に温度感受性脂質DPPC(相転移温度:約41℃)を用いた際に、光熱変換色素としてフタロシアニン誘導体(VPc)を膜に埋め込んだリポソームが、近赤外レーザー照射に応答して内包薬剤を放出できることが確認されました。
VPcを埋め込んだリポソーム(以下、VPc-Lipo)は、脂質膜の温度上昇に伴う相転移を利用して内包物を放出するため、膜付近で一定の温度上昇が生じていると考えられます。そこで、リポソーム表面に蛍光温度センサーを配置し、近赤外線レーザー照射時の温度変化を評価しました(図2)。興味深いことに、光熱変換色素による膜加温の際、わずか数ナノメートル離れた場所ではほとんど温度変化が観測されませんでした。これは、膜近傍に極めて急峻な温度勾配が形成され、発生した熱が効率的に膜の流動性変化に消費されていることを示唆しています。従って、ナノ粒子が生体組織に接触しても、光照射に伴う周囲組織への熱ダメージは抑制されることが明らかになりました。
さらに、これらの特性を応用し、VPc-Lipoを“人工シナプス小胞”として利用する可能性を検討しました。具体的には、神経伝達物質アセチルコリン(ACh)をVPc-Lipoに封入し、光照射によるACh放出を実現しました。特に脳は熱ストレスに弱い組織であるため、熱の拡散を伴わない、局所的な薬剤放出が重要です。そこで、アセチルコリン受容体を発現する筋細胞やショウジョウバエ脳にAChを内包したVPc-Lipoを配置し、近赤外レーザーで刺激しました。その結果、光刺激に応答して放出されたAChにより神経活動が活性化し、細胞のカルシウム応答が確認されました。
【今後の展開】
本研究で開発したVPc-Lipoは、アセチルコリン(ACh)以外の神経伝達物質も内包・放出できるため、今後はさまざまな神経伝達物質に対して、その動態や対応する受容体の働き、さらに神経伝達をきっかけとする細胞内シグナルの詳細な解析に役立つと期待されます。
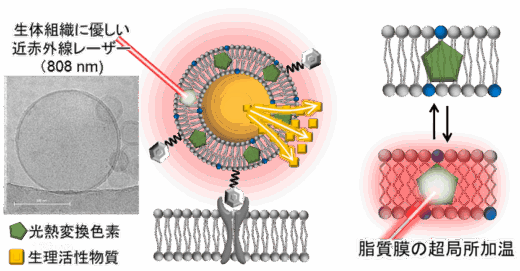
図1 近赤外線レーザーを照射するタイミングで、オンデマンドで生理活性物質を徐放できる脂質ナノ粒子。光熱変換色素が脂質膜に埋め込まれており、近赤外線照射に伴い、局所加熱が起きて、脂質膜が緩む仕組みになっている。
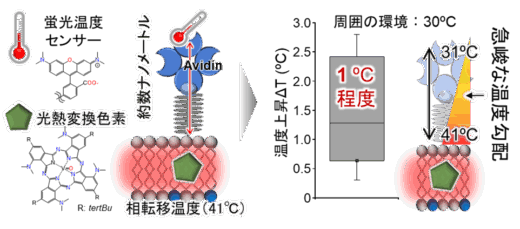
図2 近赤外線照射に伴う脂質膜近傍の温度変化の解析。近赤外線照射で、脂質膜は相転移温度の41℃に達する一方、数ナノメートル距離が離れた場所では、温度変化が観察されなかったことから、超局所加温が達成されていることが示唆されている。
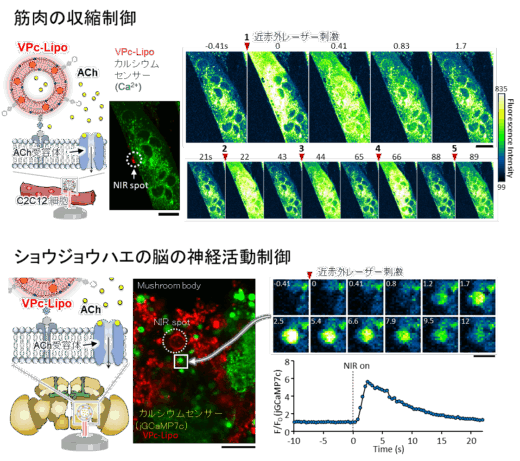
図3 人工シナプス小胞としての応用 (上段)筋分化細胞に対するアセチルコリン放出の模式図とカルシウムイメージングによるアセチルコリン受容体活性化の評価。(下段)ハエの脳(ex vivo)に対するアセチルコリン放出の模式図とカルシウムイメージングによる神経活性の観察(掲載論文のFig.8, 9を改変して転載)
掲載論文情報
- 論文タイトル
- Harnessing Dye-induced Local Heating in Lipid Membranes: A Path to Near-Infrared Light-Modulated Artificial Synaptic Vesicles (脂質膜内の色素による局所加温:近赤外光で制御できる人工シナプス小胞へ応用)
- 著者
- Satya Ranjan Sarker(サティヤ・サルケア・ランジャン)、山崎健、宗慶太郎、竹村一郎、栗田侑典、野村加代子、市村真理、鈴木崇人、甲斐麻由美、荒木 拓海、服部 真之介、古山渓行、Young-Tae Chang(ヨンテ・チャン)、木矢剛智、新井敏
- 掲載誌
- ACS Nano
- 掲載日
- 2025.07.27
- DOI
- 10.1021/acsnano.5c08482
- URL
- https://doi.org/10.1021/acsnano.5c08482

