善玉コレステロール(HDL)が産生される過程を可視化することに世界で初めて成功
・HDL※1(いわゆる善玉コレステロール)は私たちの身体にとって重要ですが、どのように産生されるのかは不明でした。
・高速原子間力顕微鏡(高速AFM)※2を用いて新生HDL※3産生過程を世界で初めて可視化した結果、これまで見たことのない新しいメカニズムであることがわかりました。
世界トップレベル研究拠点プログラム(WPI)の2拠点、①京都大学アイセムス(高等研究院 物質―細胞統合システム拠点)の植田和光特定拠点教授、小段篤史特定准教授らの研究グループと、②金沢大学ナノ生命科学研究所の古寺哲幸教授のグループは、高速原子間力顕微鏡(高速AFM)を用いて、ABCA1※4が新生HDLを形成する過程を可視化することに世界で初めて成功しました。
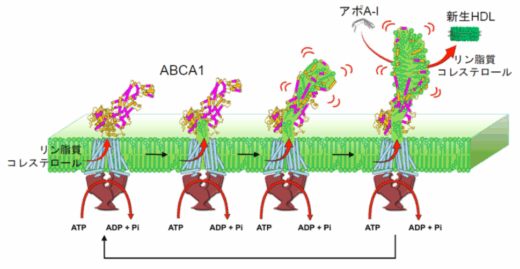
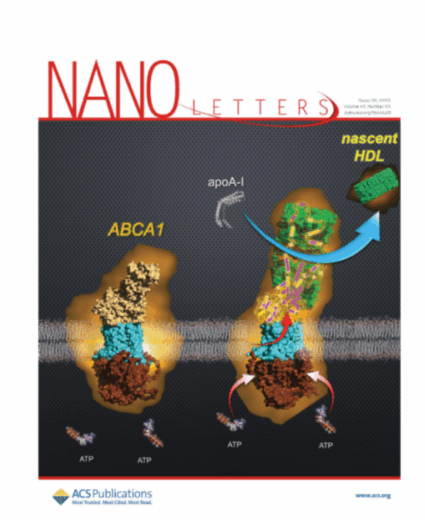 新生HDLは、数百分子のコレステロールとリン脂質の周りに2~4分子のアポリポタンパク質A-I(アポA-I)※5が巻き付いた構造をした円盤状粒子で、細胞膜上のタンパク質ABCA1の働きによって形成されます。次に新生HDLは血中で別の酵素の働きで球状の粒子となり、肝臓へ運ばれます。ところが、 ATPのエネルギーを用いてコレステロールとリン脂質を輸送するABCA1が、細胞表面でどのようなメカニズムで新生HDLを形成するのかは不明でした。
新生HDLは、数百分子のコレステロールとリン脂質の周りに2~4分子のアポリポタンパク質A-I(アポA-I)※5が巻き付いた構造をした円盤状粒子で、細胞膜上のタンパク質ABCA1の働きによって形成されます。次に新生HDLは血中で別の酵素の働きで球状の粒子となり、肝臓へ運ばれます。ところが、 ATPのエネルギーを用いてコレステロールとリン脂質を輸送するABCA1が、細胞表面でどのようなメカニズムで新生HDLを形成するのかは不明でした。
今回、研究グループは、ABCA1が輸送した数百分子のコレステロールとリン脂質を自身の細胞外ドメインに一時的に蓄積し、それらを血中のアポA-Iに一気に載せることによって新生HDLを形成することを、高速AFMを用いた可視化によって明らかにしました。本研究結果は、心血管疾患や脂質異常症の新規治療法の開発に役立つと期待されます。
本結果は、2025年8月20日に、Nano Letters誌のオンライン版に発表されました。
1.背景
HDL(いわゆる善玉コレステロール)には抗動脈硬化作用があり、血中HDL濃度は高い方がよいと一般に信じられています。しかし、実際にはHDLがどのようなメカニズムで産生されるのかはわかっていませんでした。血中のHDL濃度が非常に低いタンジール病※6の原因が、ABCA1の変異であることが1999年に発見され、HDLの産生にATP依存トランスポーターであるABCA1が必須であることはわかりましたが、ABCA1がどのようなメカニズムでHDLを産生するのかはいまだ不明でした。
タンパク質の作用メカニズムの解明には、X線結晶解析や極低温電子顕微鏡を用いた構造解析がよく用いられます。しかし、これらの方法は、反応中のタンパク質の一瞬の構造(スナップショット)の観察には有効ですが、反応を連続的に観察することはできません。本研究で用いた高速AFMは、ナノスケールの空間分解能と0.5-1秒スケールの時間分解能で、タンパク質の働きをリアルタイムに可視化することができます。今回の研究は、金沢大学ナノ生命科学研究所で開発された高速AFMを用いることによって、世界で初めて成功しました。
2.研究内容と成果
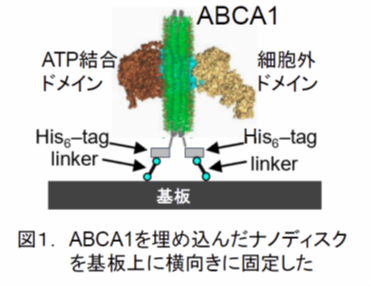
ヒト培養細胞中に発現させたヒトABCA1を、活性を保ったまま精製し、まずナノディスクに再構成しました。次に、ABCA1を含むナノディスクを高速AFMの測定基板の上に横向き(垂直)に固定する方法を開発しました。ABCA1は、細胞内のATP結合ドメインと細胞外ドメインがナノディスクの両側に突き出た構造をしています(図1)。
これまでにも、ABCA1をナノディスクに再構成しABCA1の動きを解析した研究は行われてきました。たとえば、ATP添加後の構造変化を極低温電子顕微鏡を用いて解析した2022年の論文(Sun, and Li, Nat. Cardiovasc. Res 1 (3), 2022)では直径10 nmのナノディスクを用いています。しかし、ABCA1を10 nmディスクに埋め込むと、ABCA1が輸送できる脂質は図2左のように100分子以下しか存在しません。本研究では、脂質分子をたくさん含む直径17 nmのナノディスクにABCA1を埋め込みました(図2右)。高速AFM を用いて、ABCA1の構造がATP依存的な脂質輸送に伴ってどのように変化するかを直接観察しました。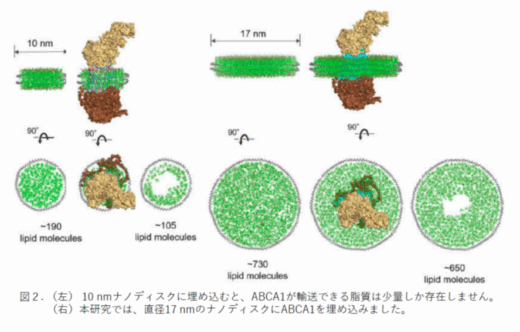
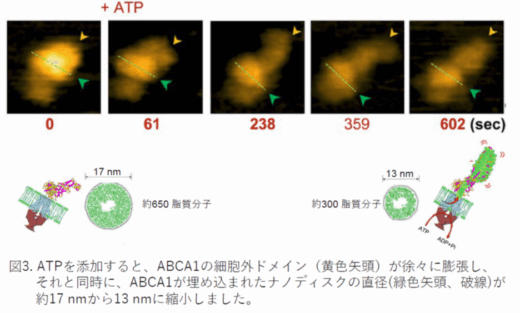
高速AFMの反応槽にATPを添加したところ、ABCA1の細胞外ドメイン(図3、黄色矢頭)がダイナミックに動きながら、600秒後に長さが約2倍に、体積が約1.6倍に増加しました。それと同時に、ABCA1が埋め込まれたナノディスクの直径(緑色矢頭、破線)が約17 nmから13 nmに縮小しました。ナノディスクの直径は含まれている脂質の量に依存しており、17から13 nmへの縮小は、300分子以上の脂質がナノディスクからABCA1の細胞外ドメインに、ABCA1の働きによって移動したことを示しています。
次に、ATPとの反応(10分間)後、反応槽にアポA-Iを添加しました。その結果、直径が約6-11 nm、厚さ約3.5 nmの小さなナノディスク(緑色矢頭)が多数形成されたことが観察できました(図4左:白矢印は、ナノディスクに埋め込んだABCA1)。さらに、ABCA1から新生HDLが形成される瞬間の撮影にも成功しました(図4右)。
今回の研究から明らかになった新生HDL産生メカニズムは以下のとおりです。
(1)ABCA1は、ATP加水分解に伴う構造変化によって、細胞膜中のコレステロールとリン脂質を外向きに移動させます。(2)ABCA1は、輸送したコレステロールとリン脂質をABCA1の細胞外ドメインに徐々に蓄積します。(3) ABCA1の細胞外ドメインには多数の両親媒性ヘリックスが存在し、それらの間の相互作用によって安定な構造を保っています。細胞外ドメインに脂質が蓄積するにつれて、両親媒性ヘリックスが脂質を包み込んだ構造への大きな再構築が起こります。(4)ATP加水分解に伴ってダイナミックに動く細胞外ドメインと血中のアポA-Iが相互作用し、数百分子の脂質が一度にアポA-Iへ移動します。その結果、二重層を形成した脂質の周りにアポA-Iが巻き付いた円盤状の新生HDLが産生されます。
3.今後の展開
抗動脈硬化作用があることから、血中HDL濃度は高い方がよいと一般には信じられていますが、産生や調節のメカニズムは十分には理解されていません。ABCA1によるHDL産生と調節メカニズムを理解することは、HDLの生理的役割を知るうえでとても重要です。今回の高速AFMを用いた可視化の研究は、HDL産生メカニズムの一端を明らかにしました。
私たちは、別の研究によって、ABCA1による新生HDL産生速度が、細胞膜内のコレステロール濃度によって厳密に制御されていることを明らかにしています(Ogasawara and Ueda, J Lipid Res 66, 100762, 2025)。つまり、ABCA1は細胞膜中のコレステロール濃度を適正に保つためにHDLを産生していると考えられます。また、私たちは、ABCA1が細胞膜の脂質二重層間にコレステロール濃度勾配を形成していることも報告しています(Ogasawara and Ueda, J Biol Chem 298, 102702, 2022)。現在までに、コレステロールとHDLの生理的役割は、未だ十分に解明されているとはいえません。コレステロールとHDLの役割を正しく理解することは、さまざまな病気の予防や治療に役立つと期待されます。
私たちは、ABCA1の作用と調節メカニズムをさらに詳細に解明することによって、コレステロールとHDLの役割を正しく理解したいと考えています。
用語解説
掲載論文情報
- 論文タイトル
- “Direct Visualization of ATP-Binding Cassette Protein A1 Mediated Nascent High-Density Lipoprotein Biogenesis by High-Speed Atomic Force Microscopy” (参考訳:ABCA1による新生HDL産生の高速原子間力顕微鏡による可視化)
- 著者
- Atsushi Kodan, Romain Amyot, Kenichi Umeda, Fumihiko Ogasawara, Yasuhisa Kimura, Noriyuki Kodera and Kazumitsu Ueda
- 掲載誌
- Nano Letters
- 掲載日
- 2025.08.20
- DOI
- 10.1021/acs.nanolett.5c03116
- URL
- https://pubs.acs.org/doi/10.1021/acs.nanolett.5c03116



全身の細胞で過剰となったコレステロールを肝臓へ運ぶ。善玉コレステロールとも呼ばれる。