温度変化を“スイッチ”に細胞機能を操る 「サーモジェネティクス」 〜医療・バイオ分野での応用に期待〜
金沢大学ナノ生命科学研究所(WPI-NanoLSI)のブー・クアン・コン特任助教、新井敏教授らの研究グループは、温度変化を“スイッチ”として標的タンパク質の機能を即時に活性化し、細胞機能を自在に制御できる新たな分子ツールの開発に成功しました。
外部刺激によって細胞の働きを操作する技術としては、これまで光を利用した「オプトジェネティクス(Optogenetics)」が広く活用されてきました。しかし、光は生体深部への到達が難しく、制御できる範囲に限界があります。そこで近年注目されているのが、熱を利用して細胞機能を制御する「サーモジェネティクス(Thermogenetics)」です。熱は光に比べて深部まで到達しやすく、生体応用に適しているという特長があります。
今回、研究チームは、アポトーシス(細胞死)に関与する酵素「カスパーゼ8(CASP8)」と、温度応答性を持つ「エラスチン様ポリペプチド(ELP)」を融合させた新しい分子ツールを開発しました。この融合タンパク質は、約35℃以上に加熱されることで凝集し、カスパーゼ8が活性化され、アポトーシスを誘導します。この仕組みは、タンパク質の局所的な濃縮によって酵素が活性化されるもので、通常の体温下では“オフ”の状態を維持し、加熱したときにだけ“オン”になるため、精密かつ安全な制御が可能です。
さらに、研究チームは、近赤外線レーザー(波長:1470ナノメートル)を用いて、狙った一つの細胞のみを局所的に加熱し、選択的に細胞死を誘導することにも成功しました。加熱の制御には、蛍光寿命イメージング(FLIM)を利用した温度センサー技術を組み合わせており、細胞内の温度をリアルタイムで可視化しながら精密に温度調整が可能です。
この技術により、がん細胞などの特定の細胞を選択的に除去したり、逆に狙った細胞だけを活性化したりすることが可能となるため、非侵襲的な治療技術としての医療応用に加え、幅広いバイオ分野への展開も大きく期待されます。
本成果は、2025年9月3日午後11時(日本時間)に米国化学会の学術誌『ACS Nano』オンライン版に掲載されました。
【研究の背景】
細胞内の標的タンパク質の活性を制御することは、細胞機能の操作に直結する重要な試みです。近年、特に、外部から照射する光に応答してそのタンパク質の機能を変化させることのできるオプトジェネティクス(Optogenetics)が注目されています。光を使うことで、空間・時間的に高精度な制御が可能です。一方、多くの場合、オプトジェネティクスでは可視光を用いるため、生体の組織深部への透過性が低いという課題の他、細胞本来が持つ内因性の光受容体を非特異的に活性化してしまう、などの課題があります。
一方で、本研究で提案しているのはサーモジェネティクス(Thermogenetics)です。これは温度変化によって、標的とするタンパク質の機能を操作し、細胞機能を制御する方法です。近赤外線や超音波などを用いることで、組織深部の局所を加温することも可能であることから、オプトジェネティクスでは困難な実験にも適用可能な実用性が期待されます。これまで、温度変化に感受して開閉するイオンチャネル(TRPチャネル)などを利用し、神経活動を制御するサーモジェネティクスツールが報告されており、ハエや哺乳類細胞、ゼブラフィッシュなどでの応用も進められています。
【研究成果の概要】
このサーモジェネティクスの概念を、より普遍的な細胞機能操作法として展開するためには、特殊な温度感受性のチャネルだけではなく、幅広いタンパク質の機能を熱で制御する手法が必要です。任意の場所と時間で、狙った細胞を加温する局所加温の技術は既に確立されていることから、温度上昇によって細胞内のタンパク質機能を制御することができれば、サーモジェネティクスの可能性は拡張できます。しかしながら、加温によって標的とするタンパク質機能を自在に“オン”にできるような設計指針は、ほとんど報告例がありませんでした。
本研究では、加熱応答性を持つエラスチン様ポリペプチド(ELP)に着目しました。ELPは温度上昇により可逆的に凝集する特性を持ち、その転移温度(Tₜ)は配列や疎水性によって調整可能です。これらの特性を活かし、ヒトのアポトーシス経路の開始因子であるカスパーゼ8(CASP8)とELPを融合させた温度依存的活性化システムを開発しました(図1)。
また、CASP8の活性化を細胞レベルで知る必要があるため、これを可視化する蛍光センサーも同時に構築しました(図2)。更に、細胞1個が感じている温度変化を知るために、定量性の高い、蛍光寿命イメージング(FLIM:Florescence Lifetime Imaging Microscopy)と蛍光温度センサーを導入しました(図3)。これらをうまく組み合わせることで、細胞の温度を測りながら、実際にCASP8が活性化されている様子を1細胞レベルでモニタリングできます。実際に、1470 ナノメートルの水を温める近赤外線レーザーで、狙った場所を加温することで、CASP8の活性を精密に制御し、単一細胞レベルで高精度なアポトーシス制御が可能であることを実証しました(図4)。
【今後の展開】
本成果で確立した手法は、本来、温度変化に対して大幅には機能変化を生じないタンパク質に、温度感受性モジュールを導入することによって、温度変化で機能がスイッチする仕組みを付与することができます。また、ELPは、そのアミノ酸の構造を変えることで、変化する温度域を改変することも可能であることから、動物・植物の種類を問わず、生物工学、細胞治療など、幅広いバイオテクノロジーへの展開が期待できます。今後、さまざまなタンパク質にこのモジュールを搭載することで、温度変化をスイッチとする多様な機能操作法(サーモジェネティクス)を生み出し、細胞機能を熱で制御する新たな研究領域「細胞熱工学」の深化を目指します。
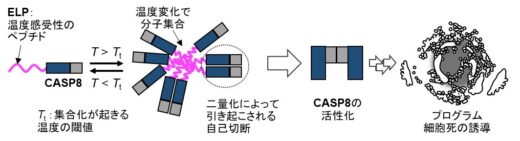
図1 ある一定温度の閾値(Tt )で起きる分子集合を活用して、カスパーゼ8(CASP8)を活性化(サーマルジェネティクス)。*細胞の図は、NIAID NIH BioArtより引用(掲載論文の図を許可を得て改変)。
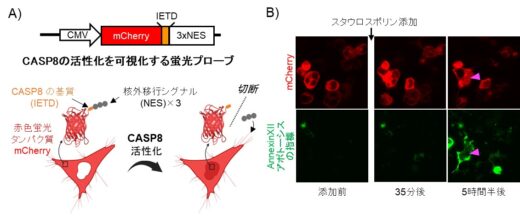
図2 カスパーゼ8(CASP8)の活性化を細胞レベルで可視化する技術。A) 蛍光プローブのデザイン。CASP8が活性化すると、赤色蛍光タンパク質が核内に移行する。B) アポトーシスを薬剤(スタウロスポリン)で誘導して蛍光プローブの機能を検証(掲載論文の図を許可を得て改変)。下段の緑色は、アポトーシスの目印となるタンパク質(AnnexinⅫ)が存在していることを示す。上段の赤色と照らし合わせると、ピンク色の三角矢印の細胞において、CASP8が活性化してアポトーシスが起こっていることがわかる。
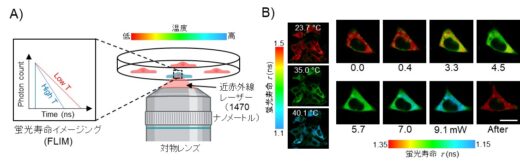
図3 蛍光寿命イメージング(FLIM)を用いた細胞温度測定。A) 温度変化で蛍光シグナル(蛍光寿命)が変化する蛍光温度センサーを活用して、細胞1個の温度を測る。B) 水を温める近赤外線レーザー(波長:1470 ナノメートル)の強度を調整することで細胞を自在に温めることができる(掲載論文の図を許可を得て改変)。
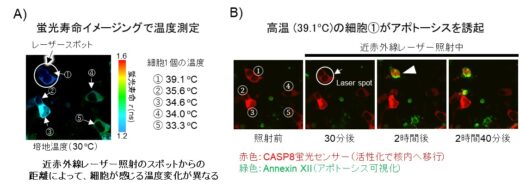
図4 近赤外線レーザーで照射した細胞を狙った、細胞死誘導。A)水を温める近赤外線レーザー照射で生じる温度勾配(細胞①~⑤)を蛍光寿命イメージングで計測。B)温度の閾値(Tt)を超えた細胞①で、プログラム細胞死が誘導される様子をCASP8蛍光プローブ(赤)で観察。細胞①で、核内が赤く光る。
掲載論文情報
- 論文タイトル
- A thermogenetic tool employing elastin-like polypeptides for controlling programmed cell death (プログラム細胞死を制御するためのエラスチン様ポリペプチドを用いたサーモジェネティクスツール)
- 著者
- Cong Quang Vu, Satoshi Arai(ブー・クアン・コン、新井敏)
- 掲載誌
- ACS Nano
- 掲載日
- 2025.09.03
- DOI
- 10.1021/acsnano.5c07332
- URL
- https://doi.org/10.1021/acsnano.5c07332

