がん撃退の新戦略第2弾: ヘルパーT細胞を活性化する改変エクソソームの開発に成功
金沢大学ナノ生命科学研究所(WPI-NanoLSI)/医薬保健研究域医学系免疫学の華山力成教授、山野友義准教授、医薬保健研究域医学系脳神経外科の中田光俊教授、木村亮堅助教らの研究グループは、細胞から分泌される微粒子「エクソソーム」を人工的に改変し、がん抗原特異的なヘルパーT細胞(※1)を選択的に活性化・分化誘導する「改変エクソソーム(AP-EV)」の開発に成功しました。
本研究は、2025年3月に報告されたがん細胞を直接攻撃するキラーT細胞(CTL)(※2)を活性化するAP-EV技術に続く第2弾として、免疫応答の中枢を担う「ヘルパーT細胞(Th1/Th2)」の制御技術を新たに確立したものです。これにより、キラーT細胞ががん細胞を直接攻撃し、ヘルパーT細胞が免疫調節を行うという二方向からの包括的ながん免疫活性化による新たな免疫療法の道が拓かれました。
エクソソームは、直径約100ナノメートルの膜小胞で、タンパク質や核酸を運搬して細胞間の情報伝達を担う、いわば「細胞間のメッセージボックス」です。本研究グループはこれまでに、キラーT細胞を選択的に活性化する改変エクソソーム(AP-EV)を開発してきましたが、今回はヘルパーT細胞に着目しました。その分化を誘導するサイトカイン(IL-12またはIL-4)をエクソソームに搭載することで、Th1型(細胞性免疫に関与)またはTh2型(液性免疫に関与)のヘルパーT細胞への分化を制御できる「AP-EV-Th1」「AP-EV-Th2」を作製しました(図1、2)。
培養細胞およびマウスモデルを用いた実験により、AP-EV-Th1はがん抗原特異的なヘルパーT細胞を選択的に活性化し、Th1型への分化および腫瘍免疫応答の増強が確認されました。これにより、がん細胞に対する強力な免疫応答が誘導され、マウスの腫瘍縮小が実証されました(図3)。
本研究は、エクソソームを用いた免疫制御技術の新たな可能性を示すとともに、キラーT細胞とヘルパーT細胞の両面からがん免疫を強化する次世代免疫療法の実現に向けた重要な一歩です。
本研究成果は、2025年6月13日(金)午前0時1分(日本時間)に、国際学術誌『Drug Delivery』のオンライン版に掲載されました。
【研究の背景】
エクソソームは、細胞が他の細胞と情報をやり取りするために放出する直径50〜150ナノメートルの微小な膜小胞であり、「細胞間のメッセージボックス」とも呼ばれます。内部にはタンパク質、脂質、RNAやDNAなどの生体分子が含まれており、受け取った細胞の機能に影響を与えることが知られています。近年、エクソソームはがん、免疫、神経疾患など多様な疾患に関与することが明らかとなり、次世代の診断・治療技術、創薬モダリティとして注目を集めています。
中でも、目的のタンパク質や核酸を自在に搭載可能な「改変エクソソーム」は、世界的に注目されている先端技術の一つです。改変エクソソームは、生体由来の膜構造を有するため、高い生体適合性や免疫回避性を備えており、抗体医薬やmRNA医薬といった他のモダリティと比較しても、安定性、細胞特異的な送達性能、複数分子の同時提示能力などの点で優れた特長を持ちます。これにより、より精密かつ柔軟な免疫制御や標的治療の実現が期待されています。
本研究グループは2025年3月、がん細胞を直接攻撃するキラーT細胞(CTL)を選択的に活性化する改変エクソソームを開発し、免疫細胞を標的ごとに精密に制御する技術を報告しました。この改変エクソソームは、抗原提示能を備えることから「抗原提示小胞(Antigen-Presenting Extracellular Vesicle, AP-EV)」と命名されました。今回の研究はその発展として、免疫応答を統率するヘルパーT細胞(Th1/Th2)に着目し、これらを選択的に活性化・分化誘導する新たなエクソソーム技術の開発に取り組んだものです。
【研究成果の概要】
エクソソームは免疫細胞間でも情報伝達の役割を担っており、内部に含まれるタンパク質やRNAなどの分子が他の免疫細胞に作用することで活性化あるいは抑制に関与することが知られています。本研究では、これまでにキラーT細胞(CTL)を選択的に活性化する改変エクソソーム(AP-EV)を開発した技術を応用し、抗原特異的なヘルパーT細胞を標的とする新たな改変エクソソームを設計・作製しました。ヘルパーT細胞の分化には、T細胞受容体(TCR)による抗原認識、共刺激分子による補助刺激、ならびにサイトカイン(IL-12またはIL-4)による分化促進の三つの要素が重要です。本研究では、それらをすべてエクソソーム表面に同時提示できるよう設計し、膜タンパク質であるテトラスパニン(CD9など)およびMFGE8(Milk Fat Globule-EGF Factor 8)を足場として各機能分子を融合させた改変エクソソームを構築しました。さらに、Th1型(細胞性免疫)またはTh2型(液性免疫)への分化を誘導するサイトカインの違いに応じて、これらの改変エクソソームをそれぞれ「AP-EV-Th1」「AP-EV-Th2」と命名しました(図2)。AP-EVは直径約100ナノメートルの小胞で、ヘルパーT細胞の約100分の1のサイズです。
培養細胞を用いた実験においては、「AP-EV-Th1」および「AP-EV-Th2」が抗原特異的なヘルパーT細胞を選択的に活性化し、それぞれTh1型およびTh2型への分化を誘導できることが確認されました(図3)。さらに、がん細胞を移植したマウスモデルを用いたin vivo実験では、「AP-EV-Th1」の投与によってヘルパーT細胞の活性化とTh1型への分化が促進され、腫瘍の増大が有意に抑制されることが示されました(図4)。
これらの成果は、エクソソームを用いて抗原特異的な免疫応答を高精度に制御する新たな手法を示すものであり、がん免疫療法の多層的強化や個別化医療への応用に向けた重要な技術的基盤となることが期待されます。
【今後の展開】
本研究により、改変エクソソームを用いてヘルパーT細胞を抗原特異的に活性化・分化誘導し、がんに対する免疫応答を高めることに成功しました。今後は、開発した抗原提示小胞(AP-EV)の安全性および有効性を評価するため、非臨床試験およびヒトを対象とした臨床試験の準備を進める予定です。これにより、AP-EVを活用した新たながん免疫療法の実現を目指します。
改変エクソソームの大きな特長は、その構造設計を柔軟に変更することで、特定の免疫細胞を標的として選択的に活性化または抑制できる点にあります。例えば、これまでに報告したキラーT細胞を活性化するAP-EV-CTLと、今回開発したヘルパーT細胞向けAP-EV-Th1を組み合わせることで、両者の協調的な作用により、がんに対する免疫応答のさらなる強化が期待されます。
また、本技術はがん免疫にとどまらず、自己免疫疾患やアレルギーなど、免疫系の過剰な活性化が関与する病態に対しても応用可能です。特定の免疫細胞の機能を抑制するように設計された改変エクソソームを用いることで、異常な免疫反応を制御する新たな治療手段としての可能性も広がっています。改変エクソソーム技術は、がん治療に加え、多様な免疫疾患への応用展開が見込まれる革新的なプラットフォームであり、今後の医療技術の進展に大きく貢献することが期待されます。
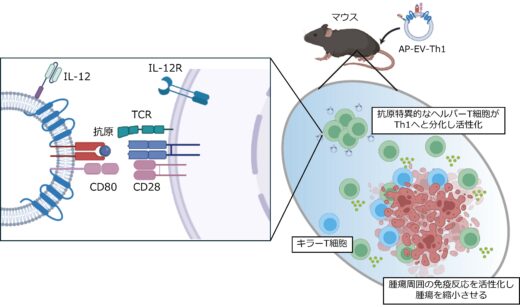
図1. AP-EV-Th1はヘルパーT細胞を増強し、がんに対する免疫応答を促進する。
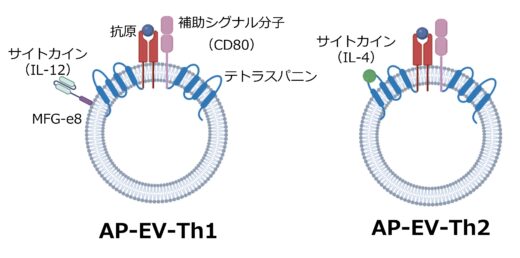
図2. 抗原提示小胞(AP-EV)は免疫細胞の分化・増殖に必要な抗原、補助シグナル分子、サイトカインを同時に発現する。
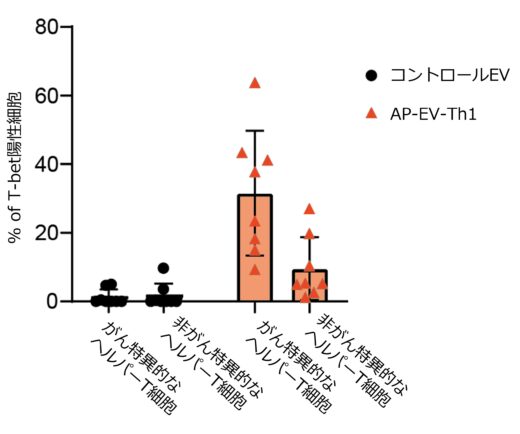
図3. AP-EV-Th1はがん特異的なヘルパーT細胞を選択的に増強する。
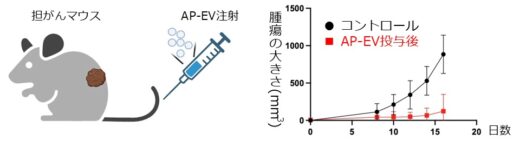
図4. AP-EV-Th1はがん細胞を移入したマウスのがんの増大を抑制する。
用語解説
掲載論文情報
- 論文タイトル
- Selective expansion and differentiation of antigen-specific CD4+ T-helper cells by engineered extracellular vesicles(改変型細胞外小胞による抗原特異的CD4陽性ヘルパーT細胞の選択的増殖と分化)
- 著者
- Ryouken Kimura#, Tomoyoshi Yamano#, †, Uryo Onishi, Xiabing Lyu, Kanto Nagamori, Toan Van Le, Mitsutoshi Nakada, and Rikinari Hanayama† (木村亮堅#、山野友義#†、大西有亮、呂夏氷、永森幹人、トアン・ヴァン・レー、中田光俊、華山力成†) #:筆頭著者 †:責任著者
- 掲載誌
- Drug Delivery
- 掲載日
- 2025.06.12
- DOI
- 10.1080/10717544.2025.2509969
- URL
- https://doi.org/10.1080/10717544.2025.2509969

