B型肝炎ウイルスの持続感染を支える ウイルス因子HBx複合体の立体構造を解明 ―ウイルス遺伝子活性化の分子基盤を可視化―
【研究成果のポイント】
- B型肝炎ウイルスの持続感染を支える完全閉環二本鎖DNA(cccDNA)からの転写を制御するウイルスタンパク質HBxとヒト因子DDB1の複合体構造を、クライオ電子顕微鏡により初めて解明しました。
- 高速原子間力顕微鏡(HS-AFM)により、HBxが柔軟かつ球状の構造動態を示すことを可視化し、その動的性質が多様な宿主因子との結合を可能にし、ウイルスの持続感染に寄与していることが示唆されました。
- HBxが宿主タンパク質と協調的に相互作用する様子を可視化したことで、B型肝炎ウイルスが宿主の抑制的エピゲノム機構をいかに回避し、ウイルス遺伝子の発現を促進しているのかという根本的な問いへの理解が大きく進展しました。今後、本研究はB型慢性肝炎に対する新たな治療戦略の基盤となることが期待されます。
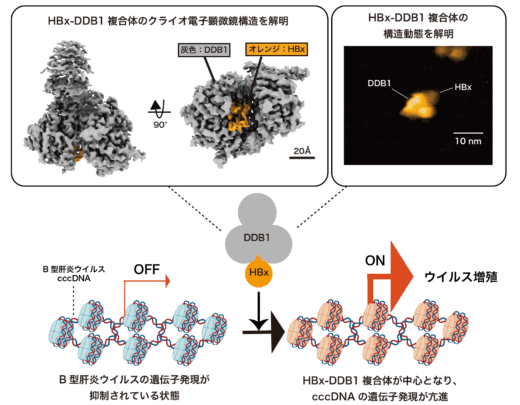
【概要】
B型肝炎ウイルス(HBV)(注1)は、世界で約2億9千万人が持続感染しており、肝硬変や肝細胞がん(HCC)の主な要因となる深刻な公衆衛生問題となっています。特に、HBVの持続感染を担うcovalently closed circular DNA(cccDNA)(注2)は、既存の治療法では完全には排除できず、根治治療の最大の障壁となっています。HBVが産生するXタンパク質(HBx)(注3)は、cccDNAからのウイルスRNA転写を促進する中心的な因子であり、その構造情報は、ウイルスの複製機構の理解や治療標的の探索において極めて重要となっています。しかし、HBxの立体構造はこれまで未解明でした。こうした背景のもと、国立健康危機管理研究機構(JIHS)国立国際医療研究所 ウイルス構造機能研究部の町田晋一テニュアトラック部長および田中大貴上級研究員は、北海道大学の前仲勝実教授、金沢大学ナノ生命科学研究所(WPI-NanoLSI)/新学術創成研究機構の柴田幹大教授、ナノ生命科学研究所(WPI-NanoLSI)炭竈享司特任助教(研究当時)、フランス国立科学センター(CNRS)のChristine Neuveut博士、熊本大学の三隅将吾教授、国立国際医療研究センター(※現:国立国府台医療センター)の溝上雅史プロジェクト長、愛媛大学の竹田浩之准教授らとの国際共同研究により、「B型肝炎ウイルスXタンパク質(HBx)複合体の構造基盤」を明らかにし、その成果を米国科学アカデミー発行の機関誌である「Proceedings of the National Academy of Sciences(Proc. Natl. Acad. Sci. USA, PNAS)」に発表しました。
本研究では、B型肝炎ウイルスの持続感染に必要なHBx複合体を、クライオ電子顕微鏡および高速原子間力顕微鏡解析によって解析し、複合体の立体構造および分子動態を世界で初めて明らかにしました。
【研究の背景と成果】
B型肝炎ウイルス(HBV)は、世界で約2億9千万人が持続感染しており、肝硬変や肝細胞がん(HCC)の主な要因となる深刻な公衆衛生問題となっています。特に、HBVの持続感染を担う完全閉環二本鎖DNA(covalently closed circular DNA(cccDNA)は、既存の治療法では完全には排除できず、根治治療の最大の障壁となっています。
cccDNAはウイルスRNA産生の鋳型となり、HBV複製の中核を担っており、感染細胞からのcccDNAの除去、もしくは遺伝子発現の恒常的な抑制が、持続感染の根治につながると考えられています。特に、HBV 由来のXタンパク質(HBx)は、cccDNAの安定性およびその遺伝子発現の亢進に重要な働きを担っており、HBxの構造機能に関する情報は、HBV複製機構の理解や新たな治療方法の探索において極めて重要です(図1)。しかし、全長のHBxは高い難溶性を示すため、その構造機能解析が大きく制限されていました。
このような背景のもと、国立健康危機管理研究機構(JIHS)国立国際医療研究所 ウイルス構造機能研究部の町田晋一テニュアトラック部長および田中大貴上級研究員らのグループは、全長HBxを、感染細胞内での主要な相互作用因子DDB1との複合体(HBx-DDB1複合体)としてヒト培養細胞にて高発現させ、大量かつ高純度に組換えタンパク質として調製することに成功しました。さらに、北海道大学の前仲勝実教授との共同研究にて、HBx-DDB1複合体をクライオ電子顕微鏡(注4)を用いて解析し、その複合体の三次元構造を解明しました(図1左、中)。その結果、HBxはV字構造を形成し、DDB1のポケット部分に結合することが明らかになりました。また、このV字構造内に形成される疎水性相互作用がHBV複製に必須であることが明らかになりました(図1右)。
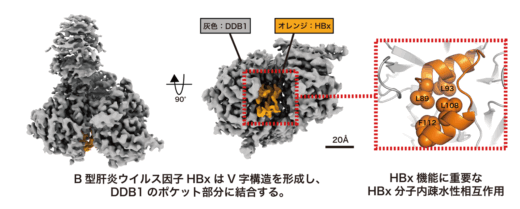
図1 B型肝炎ウイルス因子HBxとヒト因子DDB1のクライオ電子顕微鏡構造 (左、中)クライオ電子顕微鏡解析により明らかにしたHBx-DDB1複合体の密度。オレンジ色はHBx、灰色はDDB1の密度。HBxはV字構造を形成し、DDB1のポケットに結合している様子が観察された。 (右)HBx分子内に形成された疎水性相互作用は、HBxのHBV持続感染における機能に重要である。
一方で、HBx–DDB1複合体のうち、DDB1結合領域以外のHBx部分については、クライオ電子顕微鏡では構造を捉えることができませんでした。そこで、金沢大学ナノ生命科学研究所(WPI-NanoLSI)/新学術創成研究機構の柴田幹大教授、ナノ生命科学研究所(WPI-NanoLSI)の炭竈享司特任助教(研究当時)との共同研究にて、HBx–DDB1複合体全体の構造動態を高速原子間力顕微鏡(HS-AFM)(注5)により解析した結果、クライオ電子顕微鏡では可視化できなかったHBxの領域が、柔軟かつ球状の構造をとりながら動的に振る舞う様子が可視化されました(図2)。このような動的構造特性により、HBxが多様な宿主因子と柔軟に相互作用できることが示唆され、ウイルスの持続感染維持に関与している可能性が示されました。実際に、生化学的解析により、HBx-DDB1複合体が転写抑制複合体であるSMC5/6複合体の構成因子NSE3と直接結合し、その結果としてSMC5/6複合体の分解を誘導することで、cccDNAからの転写を活性化する分子機構が明らかとなりました。これにより、HBVが宿主の抑制的エピゲノム(注6)機構をいかに回避し、ウイルス遺伝子の発現を促進しているのかという根本的な問いへの理解が大きく進展しました(図3)。また、HBxとDDB1との相互作用を阻害する薬剤の開発は、B型肝炎ウイルスの増殖の中核を担うcccDNAを標的とした新規治療法戦略として期待されます。今後、本研究成果はB型慢性肝炎に対する新たな治療戦略の基盤となることが期待されます。
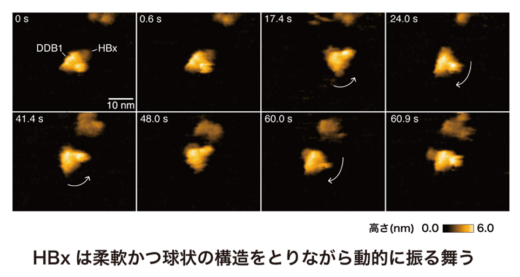
図2 B型肝炎ウイルス因子HBxとヒト因子DDB1の高速原子間力顕微鏡(HS-AFM)イメージ 高速原子間力顕微鏡(HS-AFM)により、HBx–DDB1複合体の構造動態を可視化した。クライオ電子顕微鏡では構造が捉えられなかったDDB1結合領域以外のHBx部分が、柔軟かつ球状の構造をとりながら動的に振る舞う様子が確認された。
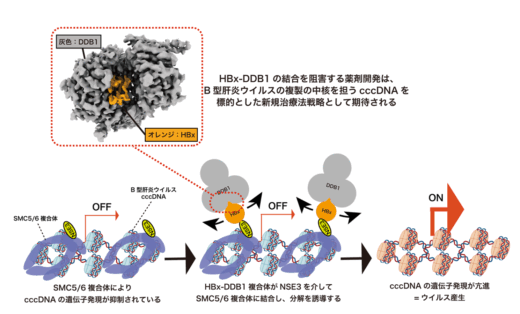
図3 HBx-DDB1複合体によるB型肝炎ウイルス遺伝子発現亢進のモデル B型肝炎ウイルスの持続感染および遺伝子発現の亢進には、ウイルス因子HBxと宿主因子DDB1の複合体形成が中核的な役割を果たしている。このHBx–DDB1結合を阻害する薬剤は、ウイルス複製の鍵となるcccDNAの機能を抑制し、B型慢性肝炎の根治につながる新たな治療法となる可能性が期待される。
【発表者・研究者等情報】
国立健康危機管理研究機構
国立国際医療研究所 ウイルス構造機能研究部 テニュアトラック部長
熊本大学 大学院医学教育部 客員教授
町田 晋一
国立健康危機管理研究機構
国立国際医療研究所 ウイルス構造機能研究部 上級研究員
田中 大貴
北海道大学大学院薬学研究院 生体分子機能学研究室 教授
前仲 勝実
金沢大学 ナノ生命科学研究所(WPI-NanoLSI)/ 新学術創成研究機構 教授
柴田 幹大
用語解説
掲載論文情報
- 論文タイトル
- Structural basis of the hepatitis B virus x protein in complex with DDB1
- 著者
- Hiroki Tanaka, Joao Diogo Dias, Basile Jay, Shunsuke Kita, Mina Sasaki, Hiroyuki Takeda, Naoki Kishimoto, Shunsuke Sasaki, Shogo Misumi, Masashi Mizokami, Christine Neuveut, Takashi Sumikama, Mikihiro Shibata, Katsumi Maenaka and Shinichi Machida*
- 掲載誌
- Proc. Natl. Acad. Sci. USA, PNAS
- 掲載日
- 2025.06.09
- DOI
- 10.1073/pnas.2421325122
- URL
- https://doi.org/10.1073/pnas.2421325122

