ハッチンソン・ギルフォード・プロジェリア症候群で細胞核膜の修復が遅延するメカニズムを解明
金沢大学ナノ生命科学研究所(WPI-NanoLSI)の河野洋平研究員、市川壮彦特任助教、志見剛特任准教授、福間剛士教授、ソウル峨山生命科学研究院の白燦基教授、東京科学大学(旧・東京工業大学)の木村宏教授らを中心とする共同研究グループは、早老症の一つであるハッチンソン・ギルフォード・プロジェリア症候群(HGPS)の原因となるラミンA・ラミンC・プロジェリン(※1)の核膜修復動態に差を生じさせている、ファルネシル化(※2)の寄与を解明、およびテール領域内の特定配列(LACS1/2)を同定しました。
本研究グループはこれまで、細胞分裂の間期にDNAを包む核膜が一部破損すると、ラミンCタンパク質が迅速に集積し修復に関与することを報告していました。しかし、ラミンAがラミンCよりも遅れて核膜へ局在するメカニズムは未解明のままでした。
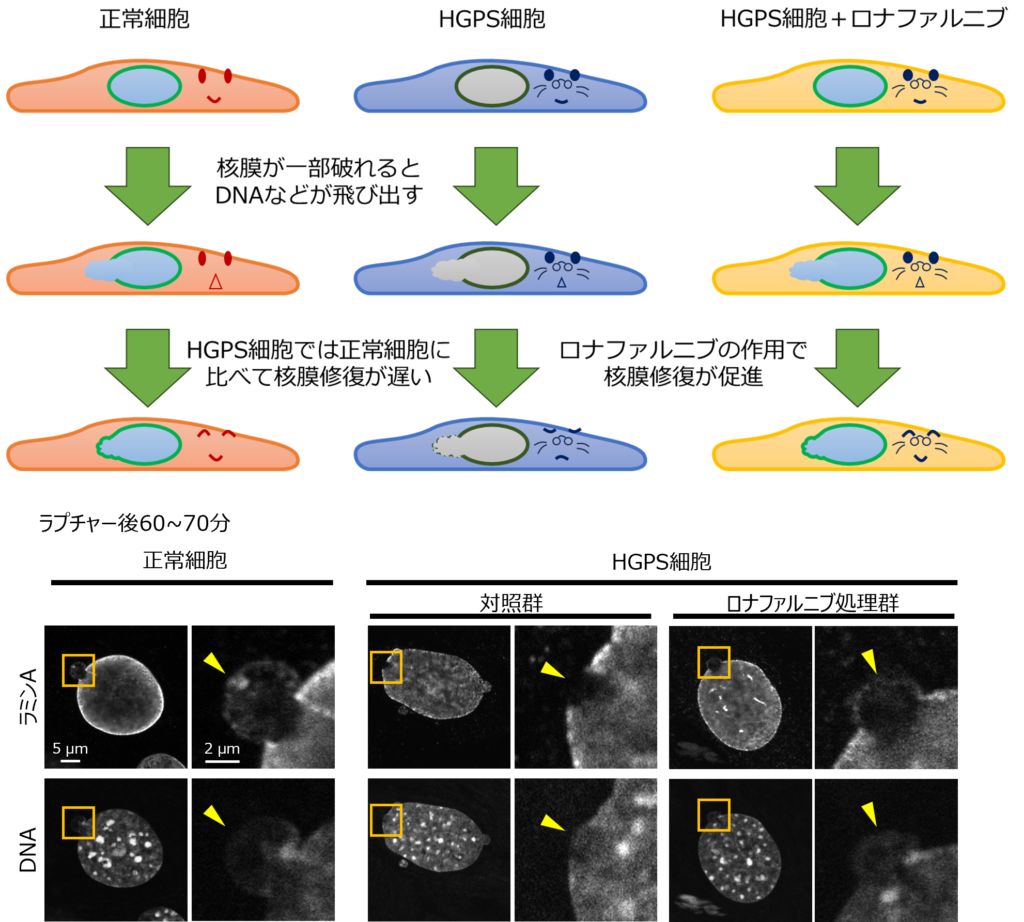
今回の研究では、原子間力顕微鏡(AFM)による任意の細胞核の圧縮技術や、共焦点蛍光顕微鏡による局所的なレーザー照射技術を用いて、核膜をラプチャー(※3)させる実験を行いました。その結果、HGPSの細胞では、正常細胞に比べて核膜の修復が遅れることが明らかになりました。また、この遅延のメカニズムを詳細に解明しました。さらに、ファルネシル転移酵素阻害薬であるロナファルニブを用いることで、核膜破損部位へのラミンの再局在化が促進されることも確認しました。
本研究は、日本と韓国に加え、米国ノースウエスタン大学、英国ロンドン大学クイーン・メアリー校、スイス・チューリッヒ大学の研究者と共同で進められた国際プロジェクトです。合計5カ国の研究者が参加する広範な国際共同研究の推進により、国際的に卓越した成果を上げることができました。
これらの知見は将来、ハッチンソン・ギルフォード・プロジェリア症候群や、ラミノパチー(※4)の治療薬開発に活用される可能性があります。また、細胞核膜およびラミンが制御するさまざまな生命現象の理解にも大きく寄与すると期待されます。
本研究成果は、2024年11月21日(英国時間)に国際学術誌『PNAS Nexus』のオンライン版に掲載されました。
研究の背景
早老症の一つであるハッチンソン・ギルフォード・プロジェリア症候群(HGPS)とは、世界的に約400万人に1人の頻度といわれる小児期発症の超希少難治性疾患です。出生時には異常がみられませんが、次第に成長障害や老化症状に似た特徴的な臨床症状が現れます。精神発達は正常ですが、年齢とともに動脈硬化症が進行し、その合併症として心筋梗塞や心不全、脳卒中を発症し、多くの場合は思春期を迎える頃に命を落とす非常に重篤な疾患です。
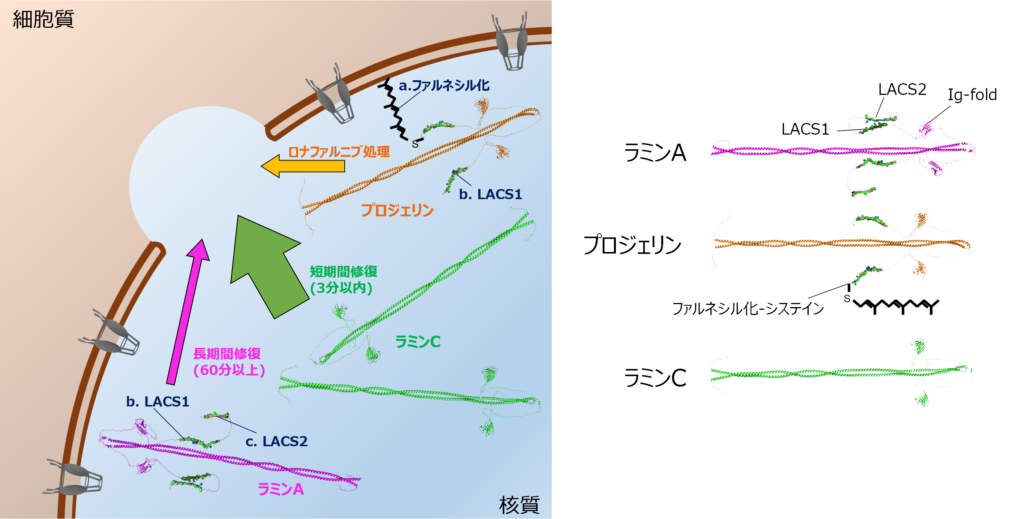
HGPSは、LMNA遺伝子の点突然変異(※5、主にc.1824C>T)によって引き起こされます。動物細胞では、DNAを包んでいる核膜のDNA側に、ラミナとよばれる薄い網目構造が存在しています。このラミナの厚さは約13.5 nmで、この極めて薄い構造がクロマチンと相互作用し、核の安定性を維持する重要な役割を果たしているとされています。そのラミナの構成成分の一つであるラミンA/Cタンパク質(LA、LC)と、HGPSの原因タンパク質であるプロジェリン(PG)は、すべてLMNA遺伝子から発現します。しかし、LAとLC、PGはテール領域の長さが異なり、特にPGは末端にファルネシル化とよばれる修飾が残ったまま核膜内膜につなぎ留められます。
健常な人の体細胞では、LMNA遺伝子から主にLAとLCが発現しますが、HGPS細胞では、LA、LCに加えてPGが微量に発現します。この微量なPG発現が、HGPSの病態形成の本質となっていると考えられています。
研究成果の概要
これまでの研究で、細胞分裂の間期にDNAを包む核膜が一部破れて孔が開いた場合、LCが迅速に集積して修復に関与する一方、LAはLCよりも遅れて局在することが分かっていました。しかし、LAの遅延の理由や、LMNA遺伝子の異常スプライシング(※6)によって発現するPGの核膜修復への影響については未解明でした。
今回、WPI-NanoLSIの研究グループは、原子間力顕微鏡(AFM)を用いて任意の細胞核を圧縮し、核膜を破損(ラプチャー)させる技術を活用しました。HGPSモデルマウス由来の細胞を解析した結果、正常細胞に比べて核膜修復が遅延することを発見しました(図1)。
さらに、東京科学大学(旧・東京工業大学)の共焦点蛍光顕微鏡の局所的なレーザー照射技術による核膜ラプチャー実験では、PGはLAよりもさらに遅れて破損部位へ局在することを確認しました。また、HGPS細胞では、LCやLAの修復動態も正常細胞に比べ遅延することが明らかになりました。また、これらの遅延は、ファルネシル転移酵素阻害薬ロナファルニブによって改善され、PGやLAの核膜修復が促進されることも明らかになりました。
さらに、LAとLCの集積動態に差が生じるメカニズムとして、LAのテール領域にLCと比べてLAの局在を遅延させる2つの配列(LACS1/2)が存在することを発見しました(図2)。
今後の展開
本研究により、HGPSにおいて核膜修復が遅延するメカニズムと、LA、PGのファルネシル転移酵素阻害薬であるロナファルニブがその改善に寄与することが示されました。これらの知見は、HGPSのみならず、LMNA遺伝子の変異によって引き起こされるラミノパチーと総称される疾患の発症メカニズム解明や、新たな治療法開発に役立つことが期待されます。また、本研究の結果からLAとLCがそれぞれ異なる役割を果たすことが強く示唆されており、これまで同一のタンパク質であるかのように扱われてきたLAとLCの生物学的意義について、基礎研究のさらなる発展が見込まれます。
用語解説
ハッチンソン・ギルフォード・プロジェリア症候群の原因となるc.1824C>T変異は、患児の両親には存在せず、各々の症例において新規に生じている。
掲載論文情報
- 論文タイトル
- Roles of the Lamin A-specific Tail Region in the Localization to Sites of Nuclear Envelope Rupture (ラミンA特異的テール領域の核膜ラプチャー部位局在化への役割)
- 著者
- Yohei Kono, Chan-Gi Pack, Takehiko Ichikawa, Arata Komatsubara, Stephen A. Adam, Keisuke Miyazawa, Loïc Rolas, Sussan Nourshargh, Ohad Medalia, Robert D. Goldman, Takeshi Fukuma, Hiroshi Kimura, Takeshi Shimi (河野洋平、白燦基、市川壮彦、小松原新大、ステファン・アダム、宮澤佳甫、ロイック・ロラ、スーサン・ノーシャー、オハッド・メダリア、ロバート・ゴールドマン、福間剛士、木村宏、志見剛)
- 掲載誌
- PNAS Nexus
- 掲載日
- 2024.11.21
- DOI
- 10.1093/pnasnexus/pgae527
- URL
- https://doi.org/10.1093/pnasnexus/pgae527