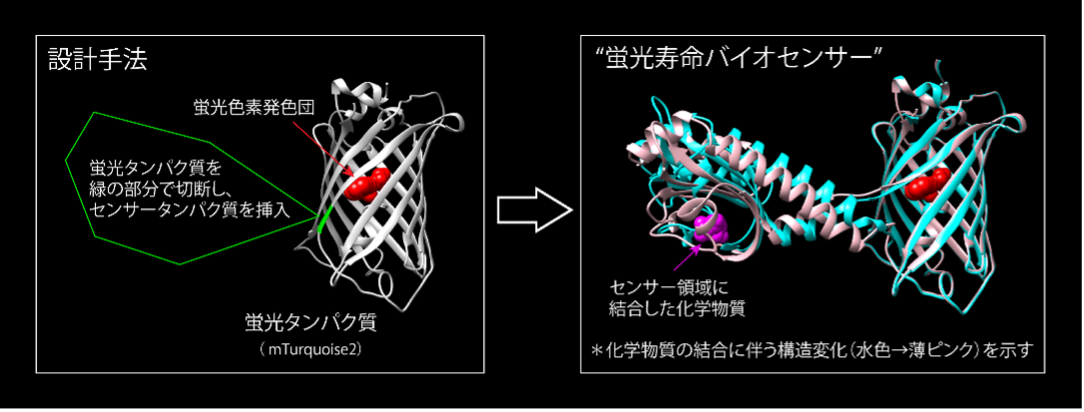
新型バイオセンサーの開発プラットフォームを確立
-さまざまな蛍光寿命バイオセンサーを簡便に設計可能-
金沢大学ナノ生命科学研究所の新井敏教授、理化学研究所(理研)生命機能科学研究センター細胞極性統御研究チームの岡田康志チームリーダー(東京大学大学院医学系研究科教授)、仲崇霞研修生(研究当時)(金沢大学大学院新学術創成研究科ナノ生命科学専攻博士後期課程学生(研究当時))の共同研究チームは、さまざまな蛍光寿命バイオセンサー(※1)を生み出すためのプラットフォームを開発しました。本研究成果は、蛍光寿命が変化する新しいタイプの蛍光バイオセンサーを簡便に作製するプラットフォームとして、広く活用されることが期待されます。
細胞が外界の刺激に反応したり、成熟して新たな機能を獲得したりするとき、細胞内情報伝達(※2)に関わる分子や代謝物の濃度が変化します。この変化を蛍光の強さや蛍光色の変化として可視化するツールが、蛍光バイオセンサーです。今回、共同研究チームは、化学物質の濃度変化を蛍光寿命の変化で捉える「蛍光寿命バイオセンサー」を新たに開発するため、測定したい化学物質と結合すると構造が変化するタンパク質(センサータンパク質)を蛍光タンパク質「mTurquoise2(※3)」に挿入する設計手法を確立しました。まずATP(※4)とcAMP(※5)のそれぞれに対する蛍光寿命バイオセンサーを開発したところ、観察対象の化学物質が存在すると蛍光寿命が変化することが確認され、この現象を利用することで細胞内の濃度変化も観察できました。さらに、クエン酸(※6)やグルコース(※7)に対する蛍光寿命バイオセンサーも同一の設計により作製でき、さまざまな標的化学物質に応じた最適化も簡単に行えることが実証されました。
本研究は、科学雑誌『Cell Reports Methods』(11月18日付:日本時間11月19日)に掲載されました。
背景
細胞が外からの刺激などに反応すると、細胞内での情報伝達や代謝に関わる化学物質の濃度が増減します。細胞を壊さずにこの変化を捉える有力な手法として、標的化学物質の増減に反応して蛍光が変化する蛍光バイオセンサーが用いられています。特に、緑色蛍光タンパク質が発見され、生物学研究に応用されるようになって以来、蛍光タンパク質を応用した蛍光バイオセンサーが、数多く開発されてきました。蛍光バイオセンサーは二つのタイプに大別され、異なる2色の蛍光タンパク質を組み合わせることで、標的化学物質の増減に反応して色が変化するタイプと、標的化学物質の増減に応じて蛍光の明るさ(蛍光強度)が増減するタイプがあります。
明るさが増減するタイプは簡便に使用することができますが、蛍光強度は蛍光分子の量や退色(※8)、その他さまざまな実験要因に影響されるため、標的化学物質の濃度を定量的に計測することは困難です。これに対し、色は実験要因による影響を受けにくいため、色が変化するタイプの蛍光バイオセンサーは、定量性に優れています。しかし、色の変化を計測するためには2色以上で計測する必要があるため、複数種類の化学物質の増減を同時に計測したい場合に使える色が足りなくなってしまう欠点があります。
蛍光に関連する第3の物理量として、蛍光寿命(※1)が知られています。蛍光寿命は蛍光分子の種類によって異なり、また蛍光分子の構造に影響する周囲の環境変化などによって変化します。また、蛍光寿命という「時間」は再現性よく定量的に計測できる物理量であるため、蛍光寿命を利用した蛍光バイオセンサーは、次世代の定量イメージング技術として注目を集めています。しかし、さまざまな生体分子に対応した蛍光寿命バイオセンサーを簡便に設計する手法は確立されておらず、開発には高額な蛍光寿命計測装置を用いた複雑なスクリーニングが必要であることから、蛍光寿命バイオセンサーの開発は立ち遅れていました。
本研究では、青緑(シアン)色蛍光タンパク質「mTurquoise2」を用い、その分子構造の特徴を生かした新たな蛍光寿命バイオセンサーの開発を目指しました。
研究手法と成果
mTurquoise2は、青緑(シアン)色蛍光タンパク質の改良型として報告された蛍光タンパク質で、明るく(100%に近い93%の量子収率(※9))、長い蛍光寿命(4.0ナノ秒。1ナノ秒は10億分の1秒)を持ちます。蛍光寿命すなわち蛍光分子が励起状態にとどまることのできる時間は、光としてのエネルギー放出だけではなく、分子内の振動などにエネルギーが漏れてしまうことにも影響されます。mTurquoise2の改良の過程では、蛍光発光部位の近くにある146番目のアミノ酸フェニルアラニンが、励起エネルギーの漏れを防ぎ、蛍光寿命を長く、量子収率(蛍光強度)を高くすることに寄与していることが示されていました。そこで、共同研究チームは、mTurquoise2の145番目のチロシンと146番目のフェニルアラニンの間に、生体分子と結合して構造変化するセンサータンパク質を挿入することを試みました。この改変により、標的化学物質との結合によるセンサータンパク質の構造変化がmTurquoise2の蛍光発光部位に影響し、蛍光寿命と量子収率を変化させることが期待できます。
実際に、細胞内でエネルギーの供給源として用いられているATPに結合するタンパク質を、センサータンパク質としてmTurquoise2に挿入すると、ATPの結合に応じて蛍光寿命と量子収率が変化することが確認されました。さらに、この挿入部分の前後のアミノ酸配列を変化させるスクリーニングで改良を試みた結果、ATPの結合によって蛍光寿命が1.0ナノ秒短く変化する蛍光寿命ATPバイオセンサーの開発に成功し、これを「qmTQ2-ATP」と命名しました。細胞内でのATP濃度変化の計測が可能であることの実証として、qmTQ2-ATPは、代謝反応を阻害する操作(解糖系阻害剤の添加)によって引き起こされる細胞内ATPレベルの変動の検出に成功しました(図1)。
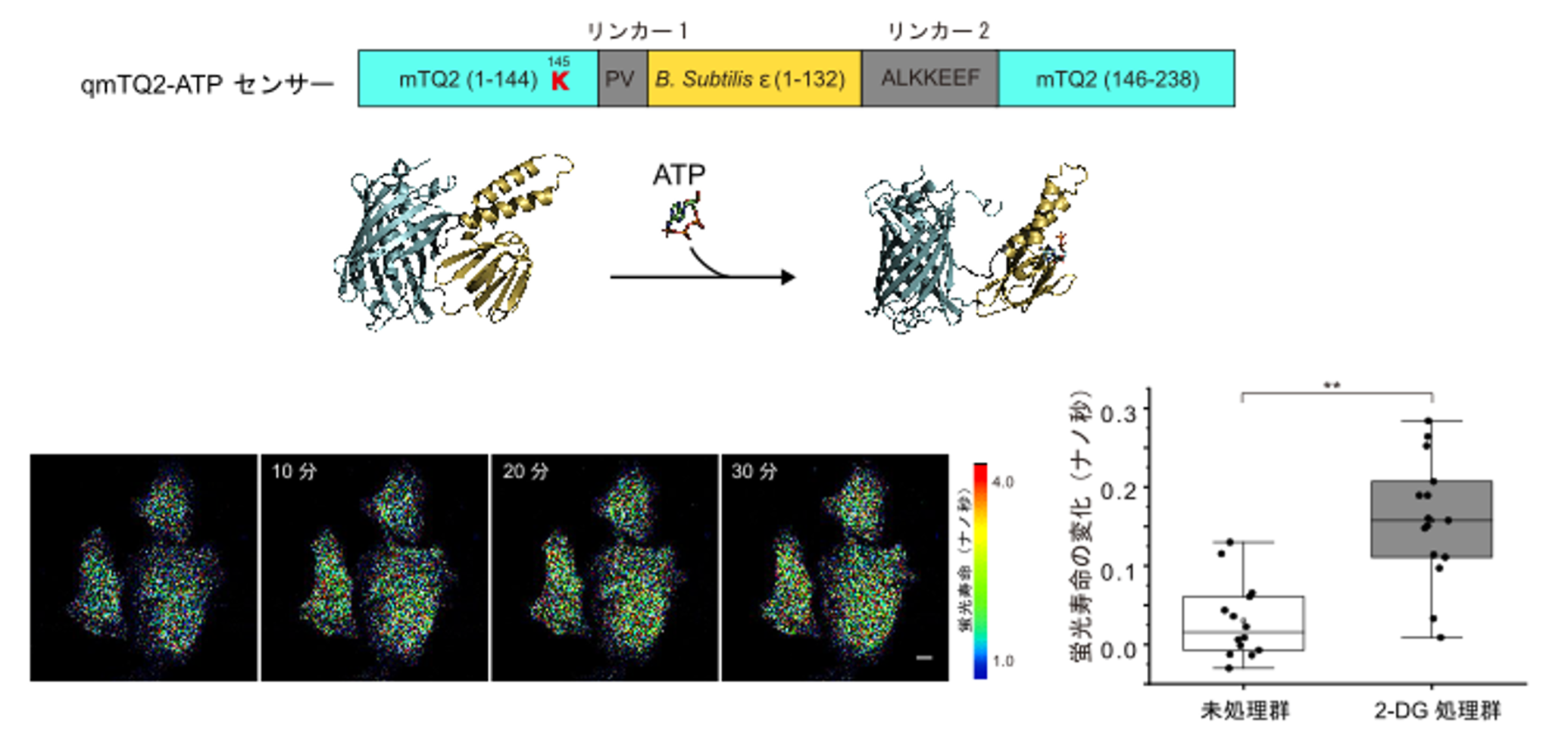
図1 細胞内エネルギー代謝評価のためのATP蛍光寿命センサーの開発
(上)qmTQ2-ATPの構造の模式図。基となった青緑(シアン)色蛍光タンパク質「mTurquoise2(mTQ2)」の145番目と146番目のアミノ酸の間に、ATPセンサータンパク質(黄色)を挿入した。2種のタンパク質をつなぐリンカー(つなぎ目)のアミノ酸配列は、さまざまなパターンをスクリーニングによって決定した。なおmTurquoise2の145番目のアミノ酸は、本来はチロシンだが、最適化の結果リジン(K)に変えている。
(中)タンパク質構造AI予測ツール「AlphaFold2」で予測した、ATPの結合に伴うqmTQ2-ATPバイオセンサーの立体構造の変化(リボンモデルで表示)。ATPの結合により、蛍光寿命が1.0ナノ秒短くなる。
(下)qmTQ2-ATPバイオセンサーを発現させたHeLa細胞(ヒトのがん由来細胞)に、解糖系阻害剤である2-デオキシ-D-グルコース(2-DG)を添加して連続観察した顕微鏡画像。蛍光寿命は、長いものを暖色系、短いものを寒色系の疑似カラーで表示した。2-DG添加により、寒色系の蛍光が減少した。スケールバーは10マイクロメートル(µm、1µmは100万分の1メートル)。右のグラフは、2-DG処理群と未処理群(対照群)の蛍光寿命の変化を比較したもの。2-DGで30分処理した群ではqmTQ2-ATPセンサーの蛍光寿命が0.1ナノ秒延び、2-DG処理によって細胞内ATPレベルが減少したことを表している。
続いて、細胞内情報伝達分子として重要なcAMPに結合するセンサータンパク質を、mTurquoise2の同じ場所に挿入したものを作製しました。これにより、cAMPの結合によって蛍光寿命が0.6ナノ秒長く変化する蛍光寿命cAMPセンサー「qmTQ2-cAMP」が得られました。培養細胞にqmTQ2-cAMPを発現させ、生理的条件下で薬剤刺激(イソプロテレノール(※10)添加)を行ったところ、細胞のcAMP応答が可視化されることも確認できました(図2)。
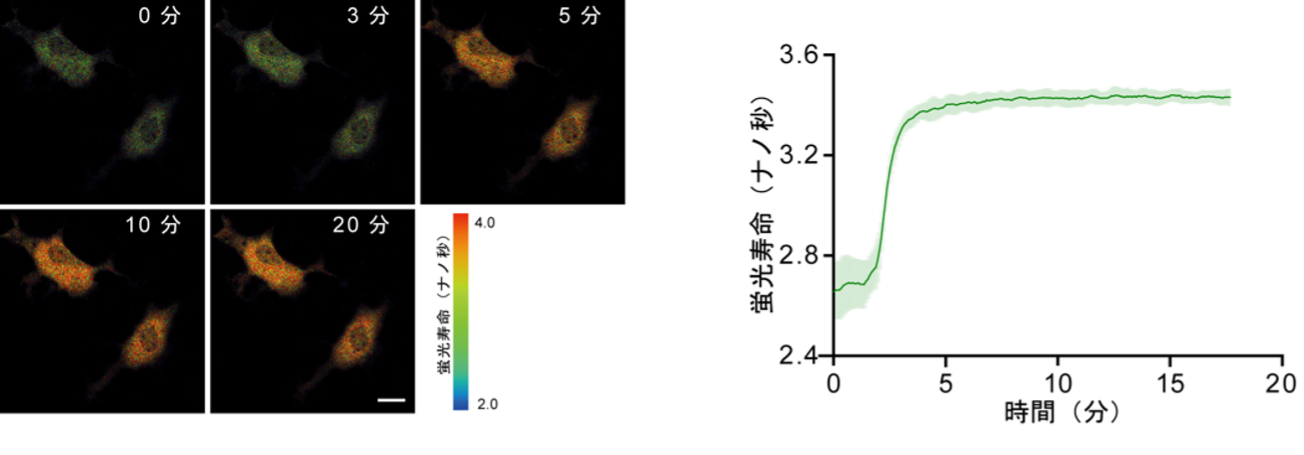
図2 細胞内cAMP可視化する蛍光寿命センサー「qmTQ2-cAMP」の開発
イソプロテレノールは細胞内cAMP濃度を上昇させる作用を持つ。qmTQ2-cAMPバイオセンサーを発現するCOS7細胞において、イソプロテレノールの処理によって誘導された蛍光寿命変化を解析した。
(左)代表的な蛍光観察画像。qmTQ2-cAMPはcAMPが結合すると蛍光寿命が長くなる。この変化を疑似カラーで暖色系として表した。スケールバーは10µm。
(右)イソプロテレノール処理後の蛍光寿命の時間経過を示すグラフ。
qmTQ2-cAMPは、青緑(シアン)色の蛍光タンパク質なので、それ以外の色の蛍光寿命バイオセンサーと組み合わせることで、他の化学物質との同時計測が可能となります。その実例として、qmTQ2-cAMPセンサーと、既存の赤色カルシウムイオン(Ca2+)蛍光寿命センサーを併用して2色蛍光寿命イメージングを試みました。細胞内cAMP濃度を上昇させるイソプロテレノールと、細胞内カルシウムイオン(Ca2+)濃度を上昇させるヒスタミン(※11)を細胞に同時に作用させ、2色蛍光寿命イメージングを行ったところ、イソプロテレノールがヒスタミンの効果を抑制し、Ca2+シグナルの最大ピークの増加を減少させることが明らかになりました。本研究で導入された定量的イメージングアプローチは、Ca2+とcAMPのシグナル伝達経路の相互調節の理解に貢献すると期待されます(図3)。これらの結果から、センサータンパク質を挿入する設計手法を確立し、蛍光寿命バイオセンサーを簡便に開発できることが分かりました。
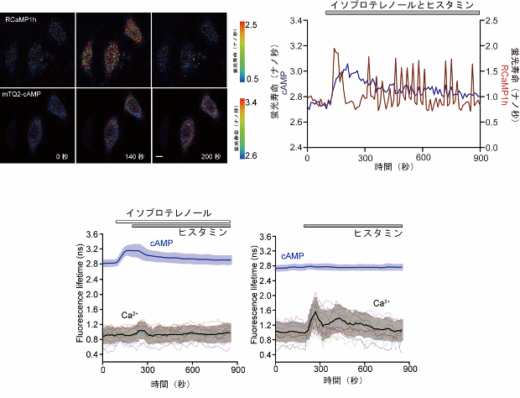
図3 蛍光寿命バイオセンサーを用いたcAMPとCa2+の2色イメージング
qmTQ2-cAMPと赤色カルシウムイオン(Ca2+)蛍光寿命バイオセンサー(RCaMP1h)を共発現するHeLa細胞に、ヒスタミンとイソプロテレノールで同時処理した際の細胞内cAMPとCa2+の濃度変化を観察した。
(上)蛍光寿命変化の代表的な画像(左)と時間経過のグラフ(右)。スケールバーは10µm。
(下)ヒスタミンのみで刺激したHeLa細胞(右)と、イソプロテレノールで事前処理後にヒスタミン刺激したHeLa細胞(左)の時間経過の比較。太線は、色付き細線で示す個別トレースを平均したトレースを示し、紫色がqmTQ2-cAMPセンサー、灰色がRCaMP1hセンサーを示す。ヒスタミン刺激はカルシウム振動を引き起こすが、イソプロテレノールはこの振動を抑制することが判明した。
最後に、今回開発した蛍光寿命バイオセンサー設計手法の拡張性を検証しました。さまざまなセンサータンパク質に対して、mTurquoise2への挿入と最適化のスクリーニングを行ったところ、クエン酸とグルコース用の蛍光寿命バイオセンサーも開発できることを示しました(図4)。
以上の結果から、本研究で実施した手法を用いることで、mTurquoise2を基にしたさまざまな蛍光寿命バイオセンサーを簡便に開発できることが確認でき、この手法は汎用性の高いフレームワークであることが示されました。
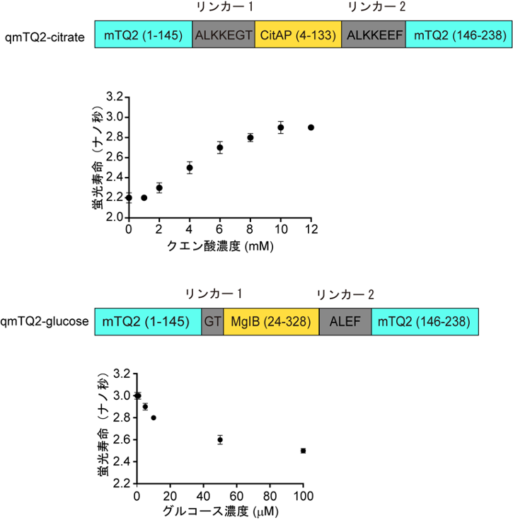
図4 クエン酸とグルコースに対する蛍光寿命センサーの開発
(上)qmTQ2-citrateバイオセンサーの模式的な構造図と、溶液中のクエン酸に対するqmTQ2-citrateバイオセンサーの検量線。クエン酸濃度の増加に伴い蛍光寿命が長くなる。
(下)qmTQ2-glucoseバイオセンサーの模式的な領域構造と、溶液中のグルコースに対するqmTQ2-glucoseバイオセンサーの検量線。グルコース濃度の増加に伴い蛍光寿命が短くなる。
今後の期待
細胞ががん化したり、iPS細胞などの幹細胞が分化したりする過程においては、細胞内のさまざまな情報伝達物質が増減し、代謝状態が変化することが知られています。本研究では、主要な情報伝達物質の一つであるcAMPや、重要な代謝物質であるATP、クエン酸、グルコースに対する蛍光寿命バイオセンサーを開発し、これらの経時変化を生きた細胞で観察できることを示しました。この蛍光寿命バイオセンサーは、厚さのある生体組織の観察に用いられる二光子顕微鏡(※12)とも相性が良いため、培養細胞だけでなく、個体内での細胞内情報伝達・代謝状態のイメージングにも適しています。
また、本研究でも実証した通り、他の色の蛍光寿命バイオセンサーと組み合わせることで、複数種類の情報伝達分子・代謝物質の同時計測が可能となります。このように、蛍光寿命バイオセンサーは、細胞のがん化や分化など細胞状態の変化を包括的かつ定量的に計測し、理解するためのツールとして重要です。
蛍光バイオセンサーはこれまで、蛍光タンパク質の色や強さの変化を計測するものが主流でした。本研究により、蛍光寿命バイオセンサー開発のハードルが下がり、多くの研究開発が行われることで、「蛍光寿命」を計測する第3のタイプの蛍光バイオセンサーの開発が急速に進むことが期待されます。
用語解説
掲載論文情報
- 論文タイトル
- Development of fluorescence lifetime biosensors for ATP, cAMP, citrate, and glucose using the mTurquoise2-based platform
- 著者
- Chongxia Zhong, Satoshi Arai, Yasushi Okada
- 掲載誌
- Cell Reports Methods
- 掲載日
- 2024.11.18
- DOI
- 10.1016/j.crmeth.2024.100902