ヒストンテールのないヌクレオソームのナノダイナミクスを可視化することに成功!
金沢大学大学院自然科学研究科数物科学専攻博士前期課程の森岡新(研究当時),金沢大学ナノ生命科学研究所(WPI-NanoLSI)/新学術創成研究機構の柴田幹大教授らの研究グループは,東京大学定量生命科学研究所の胡桃坂仁志教授らの研究グループとの共同研究で,遺伝子発現制御に重要なヒストンテールを除去したヌクレオソーム(※1)が,わずか0.3秒以内の時間スケールで「ヌクレオソームスライディング」や「DNAアンラッピング・ラッピング」を頻度よく起こすことを高速原子間力顕微鏡(高速AFM)(※2)を用いて世界で初めて明らかにしました。
各ヒストンタンパク質(H2A, H2B, H3, H4)の末端には,それぞれ長さの異なるひも状構造(ヒストンテール(※3))があります。このヒストンテールの化学的な変化(翻訳後修飾(※4))は,生命の本質とも言える遺伝子発現制御に重要であると考えられていますが,ヒストンテール自体がヌクレオソーム構造にどのような影響を与えるのかは不明でした。そこで本研究では,全てのヒストンテールや,各ヒストンタンパク質のテールを除去したヌクレオソームをそれぞれ作製し,高速AFMを用いてナノメートルスケールでの動態観察を行いました。その結果,0.3秒以内で起こる自発的なヌクレオソームスライディング(ヒストン八量体がDNAに沿って移動する現象)やDNAアンラッピング現象の動画撮影に成功しました。特に, H2BとH3のヒストンテールの除去がヌクレオソームのナノダイナミクスに大きく関与していることを明らかにしました。
高速AFM観察により,ヒストンテールそれ自体がヌクレオソームの動的な構造変化に深く関わっていることを明らかにしました。本研究結果は,今後,エピジェネティックな遺伝子発現制御の分子メカニズム解明へ向けて新しい知見を提供することが期待されます。
本研究成果は,2024年4月11日(米国東部時間)に国際学術誌『Nano Letters』のオンライン版に掲載されました。
研究の背景
私たち人間を含む哺乳類細胞のゲノムDNAは,細胞の核内において,さまざまなタンパク質と複合体を形成することでコンパクトに折り畳まれ,ヌクレオソームを基本単位とするクロマチン構造を形成しています。ヌクレオソームは,ヒストン八量体(4種類のヒストンタンパク質 [H2A, H2B, H3, H4] が各2分子ずつ集合した円盤状の構造)と,DNAが巻き付いた構造をとり(図1),それぞれのヒストンタンパク質のN末端とC末端には,ヒストンテールと呼ばれる柔軟なひも状の構造が存在します。また,生命活動の維持に必須な遺伝情報の読み取りの際には,ヌクレオソームはダイナミックに構造を変化し,読み取り部分のDNA配列が露出されると考えられています。
これまでの研究から,ヒストンテールとその翻訳後修飾が遺伝子発現にとって非常に重要であることは分かっていました。例えば,ヒストンテールを欠損させたヌクレオソームは,染色体凝集ができず,安定性が低下することや, H2BとH3 のヒストンテールのアセチル化 はヌクレオソームの運動性を促進することから,生体内で遺伝子発現の活性や抑制に非常に重要な役割を持つことが知られていました。しかしながら,生理的条件下(室温,非結晶状態,液中)で,ヒストンテール自体がヌクレオソームのナノメートルスケールのダイナミクスにどのような影響を与えるかは明らかにされていませんでした。
研究成果の概要
本研究グループは,人為的にヒストンテールを除去したヌクレオソームに高速AFM観察を適用し,わずか0.3秒以下で起こるヌクレオソームダイナミクスを可視化することに成功しました。
高速AFMは,生理的条件下にある生体分子の生きた動きそのものを,高い時空間分解能(1 ナノメートル/0.3秒以下)で可視化できる走査型顕微鏡の一つです。これまでも本研究グループにより,さまざまなタンパク質のはたらく姿が活写されています。本研究では,最初に,全てのヒストンテールを除去したallテールレスヌクレオソームの高速AFM観察を行いました。その結果,ヒストン八量体がDNAに沿ってコロコロと移動する様子(ヌクレオソームスライディング)を頻度よく撮影することに成功しました(図2)。その移動距離は,約4 ナノメートルであり,高速AFMの時間分解能である1フレーム0.3秒で完結する動きでした。さらに,研究グループは,それぞれのヒストンタンパク質のテールを除去した 4種類のヌクレオソーム(tlH2A:H2Aテール除去(以下同様), tlH2B, tlH3, tlH4 ヌクレオソーム)にも高速AFM観察を適用し,tlH2B, tlH3 ヌクレオソームにおいて,ヌクレオソームスライディングやDNA ラッピング・アンラッピングが高頻度に起こることを発見しました。H2BとH3のN末端のヒストンテールは,他のヒストンタンパク質のテールよりも長く,また,ヒストン八量体に巻かれるDNAの入口・出口付近に位置します。このことから,H2BやH3のテールの除去により,ヒストン八量体とDNAとの相互作用が弱まり,ヌクレオソーム構造が不安定になったため,ヌクレオソームスライディングやDNAアンラッピングが頻度よく起こるようになったと考えられます。つまり,H2BとH3のヒストンテールは,ヌクレオソームのナノダイナミクスに関わっていることが強く示唆されました。生体内には,ヒストンテールを分解する酵素が存在し,ヒストンテールの切断が多くの生物学的プロセスを調節することが報告されています。高速AFMで観察された,テール除去によるヌクレオソームダイナミクスの増加は,遺伝子発現制御を担う物理的な分子メカニズムの一つなのかもしれません。
今後の展開
ヒストンテールの翻訳後修飾を含むエピゲノムは,遺伝子発現制御において極めて重要な役割を担っています。本研究では,ヒストンテールによるヌクレオソームのナノダイナミクス観察という観点から,遺伝子発現制御を担う分子メカニズムの一端に迫りました。将来的には,ヒストンテールの動き自体を可視化できる技術を開発し,翻訳後修飾によるヒストンテールのナノダイナミクスや,クロマチン結合タンパク質との結合解離ダイナミクスを高速AFMで直接可視化することで,エピジェネティックな遺伝子発現制御メカニズムの理解に大きく貢献できると考えています。
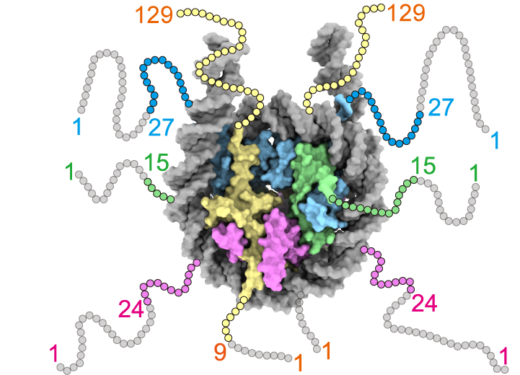
図1: ヌクレオソーム構造
ヌクレオソームは,ヒストンH2A-H2B二量体二つとH3-H4二量体二つからなるヒストン八量体にDNAが巻き付いた複合体であり,各ヒストンの末端にはヒストンテールと呼ばれる柔軟な領域がある。本研究で用いたヒストンテール欠損変異体のアミノ酸位置を,灰色の丸で示す。H2A:黄色, H2B:マゼンタ, H3:シアン, H4:緑色, DNAは灰色で示す。
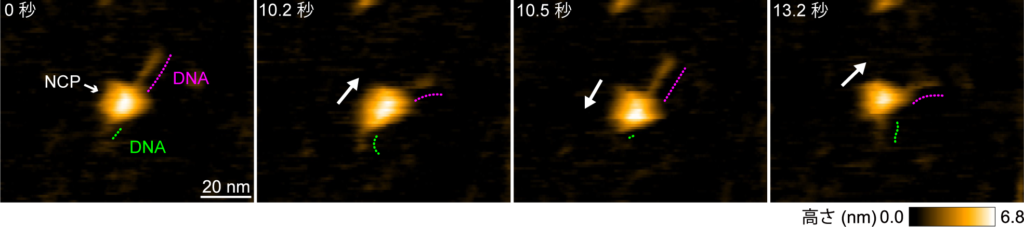
図2: 全てのヒストンテールを除去したallテールレスヌクレオソームの連続した高速AFM動画
1フレーム0.3秒で撮影。高速AFMの映像より,球状構造(NCP)が,DNA上に沿って自発的にスライディングする様子を撮影した。原著論文では動画で見ることができる。 © 2024 American Chemical Societ
用語解説
掲載論文情報
- 論文タイトル
- High-Speed Atomic Force Microscopy Reveals the Nucleosome Sliding and DNA Unwrapping/Wrapping Dynamics of Tail-less Nucleosomes (高速原子間力顕微鏡により明らかとなったテール除去ヌクレオソームのナノダイナミクス)
- 著者
- Shin Morioka, Takumi Oishi, Suguru Hatazawa, Takahiro Kakuta, Tomoki Ogoshi, Kenichi Umeda, Noriyuki Kodera, Hitoshi Kurumizaka*, Mikihiro Shibata* (森岡新,大石匠美,畠澤卓,角田貴洋,生越友樹,梅田健一,古寺哲幸,胡桃坂仁志*,柴田幹大*)
- 掲載誌
- Nano Letters
- 掲載日
- 2024.04.11
- DOI
- 10.1021/acs.nanolett.4c00801
- URL
- https://pubs.acs.org/doi/10.1021/acs.nanolett.4c00801

