「分子の拡散」と「細胞の接着」の組み合わせが, 新たな細胞領域を作り出す!
~三次元空間で組織パターン形成過程を再現~
金沢大学大学院新学術創成研究科ナノ生命科学専攻博士後期課程2年/大阪大学蛋白質研究所 特別研究学生の水野皓介,大阪大学蛋白質研究所/金沢大学ナノ生命科学研究所(WPI-NanoLSI)(研究当時)の戸田聡准教授,シンガポール国立大学メカノバイオロジー研究所の平島剛志主任研究員の研究グループは,細胞集団間のシグナル伝達を操作・解析できる三次元人工モルフォゲンシステム(SYMPLE3D)の開発に成功しました。このシステムを使って細胞の挙動を観察したところ,モルフォゲン(※1)と呼ばれる分泌タンパク質は,拡散しながら,細胞接着分子カドヘリン(※2)のタンパク質発現と連動するだけで明確な細胞領域を作り出せることを明らかにしました。
生物の発生過程において,臓器などの細胞組織の形や構造を正確に作るためには,細胞同士の緻密なコミュニケーションが不可欠です。その中でも,細胞間シグナル分子であるモルフォゲンを介した情報伝達は,多細胞パターンにおいて重要な役割を果たしていることが知られています。本研究では,合成生物学に基づく新たな手法を用いて,モルフォゲン勾配が多細胞パターンをどのように形成するのか,その仕組みに迫りました。そして,顕微鏡を用いた定量的画像解析と数理モデル解析を組み合わせることで,モルフォゲンと細胞接着分子が協調的に作用する多細胞パターン形成の基本原理を明らかにしました。これらの知見は,iPS細胞などの幹細胞を用いて目的の組織構造を精密に作り上げるための新たな組織構築技術の開発につながることが期待されます。
本研究成果は,2024年9月27日18時(日本時間)に国際学術誌『EMBO Reports』に掲載されました。
研究の背景
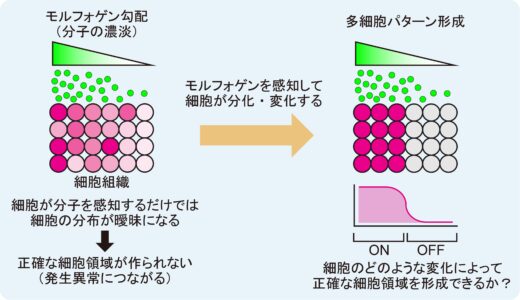
私たちの身体は,たった一つの受精卵から始まり,細胞分裂や細胞分化を繰り返すことで臓器や器官といった複雑な組織を形成します。特に発生初期において,細胞分化を正確に制御して多細胞パターンを構築するためには,モルフォゲンと呼ばれる拡散性タンパク質を介した細胞同士のコミュニケーションが重要です。モルフォゲンは特定の細胞から分泌され,細胞組織中を拡散して濃度勾配を形成します。この濃度勾配が位置情報として機能し,モルフォゲンの濃度に応じて細胞分化が決まり,多細胞パターンが作られます。しかしながら,モルフォゲン濃度勾配が細胞組織にどのように作用し,正確な多細胞パターンを作り上げているのか,その基本的な仕組みは十分に解明されていませんでした(図1)。その理由の一つは,モデル動物のような複雑な生体システムの中で多細胞パターンに関わる要素だけを切り離して解析することが難しい点にあります。そこで,本研究では,モルフォゲンによって作られる多細胞パターンをシンプルな環境で解析することを目指しました。
【研究成果の概要】
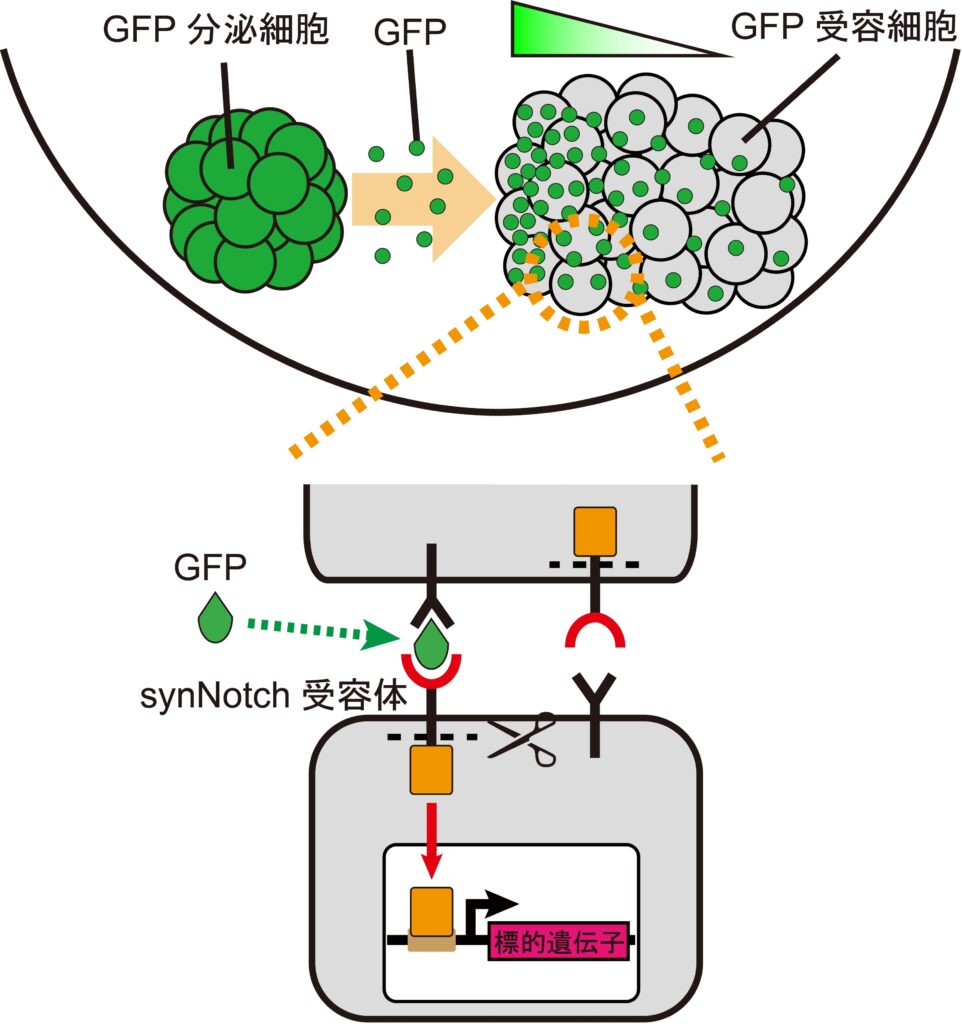
本研究グループは,培養細胞株であるマウス線維芽細胞を使い,モルフォゲンによる多細胞パターン形成をin vitroで解析するシステムを開発しました(図2)。このシステムでは,モルフォゲン分子と見立てた緑色蛍光タンパク質(GFP)を分泌する細胞(GFP分泌細胞)とGFPを受け取る細胞(GFP受容細胞)のコミュニケーションを介して,GFP受容細胞側に遺伝子発現誘導を行います。具体的には,GFP受容細胞にsynNotch受容体(※3)と呼ばれる人工受容体を発現させることで,標的遺伝子の誘導を実現しました。さらに,GFP分泌細胞とGFP受容細胞をスフェロイド(細胞の塊)として混合培養することで,三次元空間における多細胞動態が観察できます。このように,細胞に元々備わっていない人工的なシステムを組み込むことで,特定の因子に焦点を当てた解析が可能となりました。このシステムを我々は,SYnthetic Morphogen system for Pattern Logic Exploration using 3D spheroids (SYMPLE3D)と名付けました。
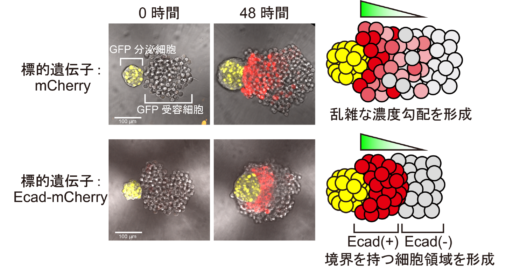
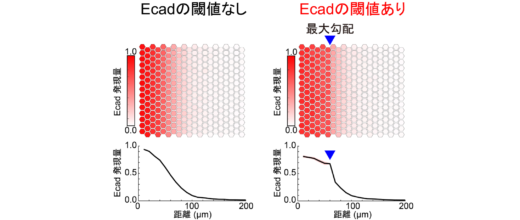
この SYMPLE3Dを用いて,まずは,標的遺伝子が赤色蛍光タンパク質(mCherry)の受容細胞について多細胞パターンを観察したところ,GFPの勾配に応じた乱雑なmCherryの勾配を形成し,特徴的なパターンは観察されませんでした(図3上段)。そのため,我々はどのような標的遺伝子を誘導すればこの乱雑な勾配パターンを変化させられるかを考え,細胞接着因子であるE-カドヘリン(Ecad)に注目しました。細胞接着因子は,発生過程において,神経管を始めとした組織のパターン形成に寄与することが報告されていますが,その詳細な仕組みは未解明でした。そこで,標的遺伝子としてEcadとmCherryの融合タンパク質を発現する細胞を作製し,多細胞動態を観察したところ,驚くべきことにEcad陽性細胞集団と陰性細胞集団,二つの細胞領域が観察されました(図3下段)。この時,細胞接着分子Ecadという一つの因子を足しただけでパターンに大きな変化が見られたので,次に我々はEcadの機能に的を絞って,パターン形成過程の詳細な解析を行いました。
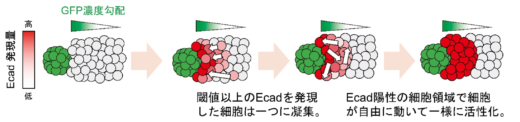
その結果,今回見られたパターン形成には,二つの仕組みが重要であることが明らかになりました(図4)。一つ目がEcadのスイッチ様の振る舞いです。さまざまなEcad発現量の細胞を用いて細胞挙動を解析したところ,低濃度のモルフォゲンを受容してEcadをわずかに発現した細胞も,高濃度のモルフォゲンを受容してEcadを強く発現した細胞も,どちらもその振る舞いが変わらないことを見出しました。つまり,ある一定量以上のモルフォゲンを受け取ってEcadを発現した細胞は,発現量に関係なく互いに相互作用して,一つの細胞集団を形成することができることが分かりました。二つ目が,Ecad陽性細胞集団の中での細胞運動です。我々は当初,Ecadを発現すると細胞同士の接着力は強くなるので細胞の動きが制限されると予想していましたが,細胞の動きを観察した結果,予想に反して,細胞は自由に動き回り,配置を容易に変えられることが分かりました。これらの仕組みによって,細胞はGFPを均一に受け取ることができるので,Ecadの発現量は均一化されます。以上のメカニズムよって,モルフォゲン勾配に従って細胞接着分子Ecadを誘導するだけで,明瞭な境界を持つ細胞領域を形成できることが分かりました。また,数理モデルを使ったシミュレーション解析によっても,細胞実験から見出された二つの仕組みが細胞領域の形成に十分であることを実証しました(図5)。
【今後の展開】
本研究では,できるだけシンプルな細胞環境でパターン形成過程を解析することで,モルフォゲンの拡散とそれに応じた細胞接着分子の発現によって,二つの細胞領域が作られることを明らかにしました。しかし,生体内では,複数のモルフォゲンが作用することで,より多くの細胞領域が形成されます。今後は,本研究で開発したin vitroシステム(SYMPLE3D)を基に,パターン形成に関わる因子をさらに足していくことで,より複雑な多細胞パターン形成に必要な条件を解明することを目指します。また,生命現象の理解に加えて,将来的には,細胞医療や再生医療を見据えた組織構築技術としても発展させていきます。
用語解説
掲載論文情報
- 論文タイトル
- Robust tissue pattern formation by coupling morphogen signal and cell adhesion. (モルフォゲンシグナルと細胞接着の連動による強固な組織パターン形成)
- 著者
- Kosuke Mizuno, Tsuyoshi Hirashima, Satoshi Toda (水野皓介,平島剛志,戸田聡)
- 掲載誌
- EMBO Reports
- 掲載日
- 2024.09.27
- DOI
- 10.1038/s44319-024-00261-z
- URL
- https://www.embopress.org/doi/full/10.1038/s44319-024-00261-z