ナイアシン代謝物の高感度バイオセンサーを開発!
金沢大学ナノ生命科学研究所(WPI-NanoLSI)/がん進展制御研究所の上野将也助教,平尾敦教授,大学院医薬保健学総合研究科医学専攻/ナノ精密医学・理工学卓越大学院プログラム履修者の杉山雄紀(博士課程4年),ナノ生命科学研究所(WPI-NanoLSI)のリ・ホウ特任助教(研究当時,現・北海道大学大学院工学研究院助教),京都大学大学院工学研究科/金沢大学ナノ生命科学研究所(WPI-NanoLSI)の生越友樹教授らの研究グループは,ナイアシン(※1)代謝物を迅速に検出できる超分子バイオセンサー(P6AS,※2)を開発しました。
がんやメタボリックシンドロームでは,病態と代謝異常が密接に関わっており,患者の代謝状態を詳細にすることは診断や治療において極めて重要です。代謝物の測定は,主に質量分析計が用いられていますが,測定に時間がかかることや,高価な機器とその操作を熟知した技術者が必要なため,迅速で低コストの測定技術が求められています。
WPI-NanoLSIでは,以前からナイアシン代謝物の1-メチルニコチンアミド(1-MNA)を検出するために,バイオセンサーを開発してきました。1-MNAは,ナイアシンが肝臓の酵素により代謝された代謝物で,尿中に排出されます。一方,1-MNAはがん細胞でも産生が亢進しており,がんのバイオマーカーになることが示唆されています。今回,本研究グループは従来のセンサーを化学的に改変して高感度化に成功し,1-MNAを迅速に検出できる超分子バイオセンサー(P6AS)を開発しました。P6ASを用いることで,これまで困難だった未精製の生体サンプル中の1-MNAを,質量分析計を使わずに,簡便かつ迅速に測定することに成功しました。
これらの知見は,肝機能診断法の確立や,がん細胞の可視化技術への応用が期待されます。
本研究成果は,2024年8月25日(米国時間)に米国科学誌『Analytical Chemistry』に掲載されました。
【研究の背景】
食事により体内に取り込まれた糖質,脂質,タンパク質,アミノ酸,ビタミンなどの栄養素は,さまざまな酵素により代謝されます。恒常性の維持には,分解によってエネルギーを得る異化反応と,エネルギーを使って生体に必要な物質を合成する同化反応が適切に制御される必要があります。一方,がんやメタボリックシンドロームなどの加齢に伴う病気では,糖,脂質,あるいはエネルギー代謝などに異常がみられ,代謝がさまざまな病気に関わっていることが明らかになっています。従って,患者の代謝状態を把握することは診断や治療において極めて重要であり,血液や尿中の代謝物を正確に測定する技術が不可欠です。
生体サンプルには,多種多様な代謝物が含まれており,特定の代謝物を測定するには,測定したい代謝物を正確に検出する必要があります。質量分析計は,物質固有の質量と化学的性質から,目的の代謝物を極めて正確に同定することができるため,さまざまな代謝物の測定に用いられています。しかしながら,測定に時間がかかることや,スループットの限界,さらに,高価な機器とその操作を熟知した技術者が必要なため,一般的な病院での実施は難しく,質量分析法に変わる迅速で低コストの測定技術が求められています。
【研究成果の概要】
ナイアシンは水溶性ビタミンの一つで,ニコチンアミド・アデニン・ジヌクレオチド(NAD+)の前駆体です。このNAD+は生体内のエネルギー,糖,脂質,タンパク質などさまざまな代謝に関わっており,ナイアシンは極めて重要なビタミンと言えます。一方,ナイアシン(ニコチンアミド)は,肝臓でNNMT(※3)によりメチル化されて,1-メチルニコチンアミド(1-MNA)に代謝され,尿中に排出されます(図1)。この1-MNAの尿中排出は,肝硬変患者で亢進していることが知られており,1-MNAの測定は肝硬変の診断に応用できることが期待されています。また,がん細胞でもNNMT の発現が亢進していることから,1-MNAが,がんのバイオマーカーになることが示唆されています。
以前,WPI-NanoLSIの研究グループは,ピラーアレーン(P6AC)が1-MNAのバイオセンサーとして機能することを報告しました。ピラーアレーンは生越教授らが初めて合成に成功した,金沢大学発の柱型環状化合物です(図2)。本研究グループは,P6ACは1-MNAを分子内部の空洞に取り込んだ”ホスト−ゲスト複合体”を形成することができ,この結合に伴いP6ACの蛍光が消光することを報告しました(図3)。この原理を利用することで,P6ACを混合して蛍光を測定するだけで,サンプル中の1-MNAを測定することが可能になりました。しかしながら,P6ACの検出感度が低いため,測定できる検体は1-MNAが高濃度に含まれるマウス尿検体に限られ,さらに測定するには,濃縮や精製などの煩雑な前処理が必要でした。
そこで,本研究グループは,センサーの検出感度を改善する目的で,カルボン酸より酸性が強いスルホン酸基を持つピラーアレーンP6ASを合成しました(図4)。本研究グループは,P6ASが1-MNAとホスト−ゲスト複合体を形成し,その結合はP6ACより700倍強いことを発見しました。このP6ASをセンサーに用いることで,検出感度が飛躍的に上昇し,がん細胞が培養液中に産生した1-MNA(数μM程度)を定量することに成功しました(図5)。さらに,P6ASは,未精製のヒト尿中の1-MNAを直接検出することが可能で,質量分析計で測定した結果と,P6ASを用いた蛍光測定値が高い相関性を示しました(図6)。すなわち,P6ASを用いることで,これまで困難だった未精製の生体サンプル中の1-MNAを,質量分析計を使わずに,簡便かつ迅速に測定することに成功しました。
【今後の展開】
これらの知見により,迅速な肝機能診断法の確立や,がん細胞の術中診断や可視化技術への応用が期待されます。さらに,NNMT阻害剤のハイスループット・スクリーニングや新たなバイオセンサーの創出に貢献することが期待されます。
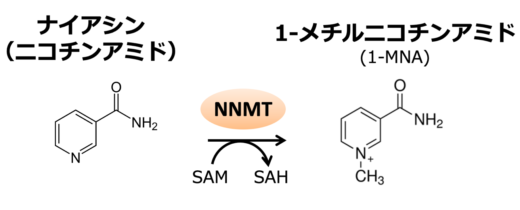
図1:ニコチンアミドはNNMT(nicotinamide N-methyltransferase:ニコチンアミド N-メチル基転移酵素)によって1-メチルニコチンアミド(1-MNA)に代謝され,尿中へ排泄されます。
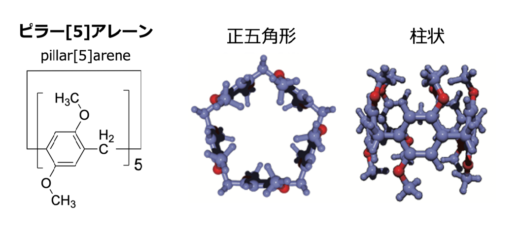
図2:ピラー[5]アレーンは生越らの研究グループが初めて合成に成功した超分子化合物で,1,4-ジアルコキシベンゼンがパラ位で結合した柱型環状構造を有しています。
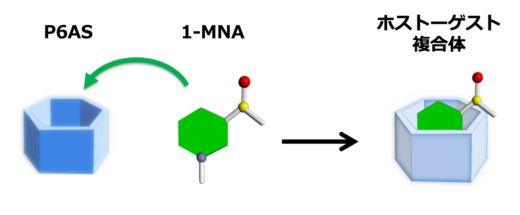
図3:P6AC(あるいはP6AS)は空洞に1-MNAを取り込んで安定なホスト−ゲスト複合体を形成し,これに伴い蛍光が消光します。
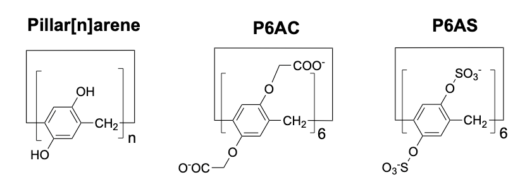
図4:水溶性ピラー[6]アレーン(P6AC)はピラーアレーンの類縁体で,分子内に12個のカルボキシ基を持っています。また, P6ASは12個のスルホ基を持っています。これらのピラーアレーンは分子中央に電子豊富な空洞を持ち,この中に陽イオン分子を取り込んで安定したホスト−ゲスト複合体を形成します。
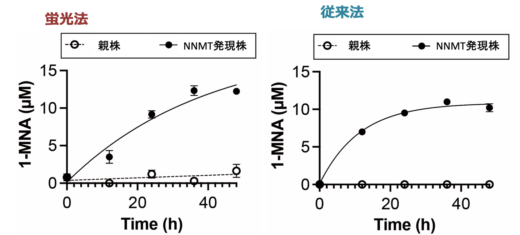
図5:がん細胞から培養液中に産生される1-MNAを,P6ASを用いた蛍光法と質量分析計を用いた従来法で測定しました。培養液にP6ASを添加して蛍光を測定するだけで,従来法と同等の結果が得られました。
親株:NNMTをほとんど発現していない細胞で,1-MNAの産生が見られない
NNMT発現株:NNMTを強制発現させた細胞で,1-MNAを培養液中に産生することができる
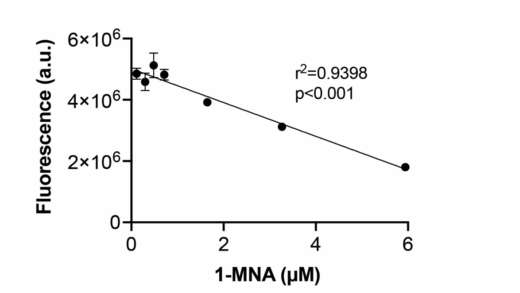
図6:健常人にナイアシンを服用してもらい,一定間隔で採尿することで,尿中1-MNA濃度が異なる尿サンプルを作成しました。このサンプルの1-MNAの濃度と,P6ASを添加した時の蛍光値をプロットしました。 1-MNAの濃度と蛍光値に強い相関が見られたことから,P6ASは,未精製の尿中でも,特異的に1-MNAを検出できることが示唆されました。
用語解説
P6AS:分子内に12個のスルホ基を持つピラーアレーン
P6AC:分子内に12個のカルボキシ基を持つピラーアレーン
掲載論文情報
- 論文タイトル
- A supramolecular biosensor for rapid and high-throughput quantification of a disease-associated niacin metabolite (疾患に関連するナイアシン代謝物の迅速かつハイスループットな定量を可能にする超分子バイオセンサー)
- 著者
- Masaya Ueno, Hiroki Sugiyama, Feng Li, Tatsuya Nishimura, Hiroshi Arakawa, Xi Chen, Xiaoxiao Cheng, Shinji Takeuchi, Yumie Takeshita, Toshinari Takamura, Sakae Miyagi, Tadashi Toyama, Tomoyoshi Soga, Yusuke Masuo, Yukio Kato, Hiroyuki Nakamura, Hiromasa Tsujiguchi, Akinori Hara, Atsushi Tajima, Moeko Noguchi-Shinohara, Kenjiro Ono, Kenta Kurayoshi, Masahiko Kobayashi, Yuko Tadokoro, Atsuko Kasahara, Mahmoud I. Shoulkamy, Katsuhiro Maeda, Tomoki Ogoshi, Atsushi Hirao (上野将也,杉山雄紀,リ・ホウ,西村達也,荒川大,陳茜,シャウシャウ・チン,竹内伸司,竹下有美枝,篁俊成,宮城栄重,遠山直志,曽我朋義,増尾友佑,加藤将夫,中村裕之,辻口博聖,原章規,田嶋敦,篠原もえ子,小野賢二郎,倉吉健太,小林昌彦,田所優子,笠原敦子,マハムド=イブラヒム・シャルカミ,前田勝浩,生越友樹,平尾敦)
- 掲載誌
- Analytical Chemistry
- 掲載日
- 2024.08.25
- DOI
- 10.1021/acs.analchem.4c02653
- URL
- https://pubs.acs.org/doi/10.1021/acs.analchem.4c02653

