脳の記憶と学習の謎に迫る! ナノスケールで捉えたグルタミン酸受容体の驚きの動き
金沢大学ナノ生命科学研究所(WPI-NanoLSI)/新学術創成研究機構の角野 歩助教, 柴田幹大教授,ナノ生命科学研究所(WPI-NanoLSI)の炭竈享司特任助教らの研究グループは,中国・復旦大学生命科学学院の服部素之教授らの研究グループとの共同研究で,脳の記憶や学習に重要な役割を果たすAMPA型グルタミン酸受容体(AMPA受容体, ※1)の細胞外ドメインのナノメートルスケールでの動きを,高速原子間力顕微鏡(高速AFM,※2)を用いて世界で初めて動画撮影することに成功しました。
AMPA受容体は,脳のシナプスで興奮性神経伝達を担うタンパク質です。これまで,信号を受け取るとシナプス後部にAMPA受容体が集合して,伝達効率を高めると考えられてきました。しかし,AMPA受容体がシナプスに留まって集合する分子メカニズムは完全には理解されていませんでした。今回の研究では,高速AFMを用いて,AMPA受容体の細胞外ドメインが大きく揺れ動く様子を可視化することに成功しました。さらに,これまで強固と考えられていた二量体(ダイマー)構造が,実際には一つずつに分離し,分裂と結合を繰り返す様子を観察しました。この「ダイマー分裂」により,複数のAMPA受容体が互いに結びつきやすくなり,さらに,シナプスで放出されるシナプスオーガナイザー分子との結合力が高まる可能性が示されました。これにより,「ダイマー分裂」がAMPA受容体のシナプスへの集合を促す分子機構の一部であることが明らかになりました。AMPA受容体はてんかん発作を引き起こす重要な分子であり,その動作を阻害する薬剤が治療方法として重要視されています。本研究の結果は,興奮性神経伝達の分子メカニズムに新たな知見を与え,関連する疾患に対する画期的な治療薬の創出に寄与すると期待されます。
本研究成果は,2024年8月23日22時(現地時間)に国際学術誌『ACS Nano』のオンライン版に掲載されました。
研究の背景
私たちの脳は,1000億個の神経細胞が連結して形成された神経回路で成り立っています。神経細胞同士の接続点にはシナプスと呼ばれる領域があり,シナプス前部の神経細胞からは神経伝達物質が放出され,シナプス後部の神経細胞には,その物資を受け取る受容体があり,信号の伝達が行われます。シナプスは一度作られてからも,環境や学習による神経活動によって変化することが分かっています。この適応性は「シナプスの可塑性(※3)」と呼ばれ,記憶や学習の分子メカニズムを理解する上でとても重要です。また,シナプスの異常が関係するさまざまな神経疾患を解明するためにも,シナプスの可塑性は非常に重要な研究対象となっています。
AMPA型グルタミン酸受容体はGluA1からGluA4の4つのサブユニットからなり,四量体のイオンチャネル型受容体として,中枢神経系の興奮性シナプスの可塑性に重要な役割を果たします。シナプス後部では,神経活動に応じてAMPA受容体の数やサブユニットの組み合わせが変化し,信号伝達の効率に大きく影響を及ぼします。また,AMPA受容体は神経細胞のシナプス外側からシナプス後部に集まることが知られています。そのため,神経活動に応じてシナプス後部へのAMPA受容体の迅速な移動と集合が求められます。これまでに,AMPA受容体の構造は,X線結晶構造解析や低温電子顕微鏡法(cryo-EM)により明らかにされ,縦長の大木のような形をとり,その構造の約半分が細胞外側の大きなドメイン(N末端ドメイン; NTD)として存在することが分かりました(図1)。さらに,さまざまな生化学実験や細胞実験により,NTDが欠損すると,AMPA受容体のイオンチャネル機能は保持されるものの,シナプスへの移動と集合が妨げられることが示されました。しかし,どのようにしてこのNTDがシナプスでの集合を誘導するのか,その詳細な分子メカニズムは依然として謎のままでした。そこで,本研究では,高速AFMという顕微鏡技術を用い,脂質二重膜内に埋め込まれたAMPA受容体のNTDの動きをナノメートルスケール,かつ,リアルタイムで可視化し,シナプス領域への集合に関わる分子メカニズムの解明を試みました。
研究成果の概要
本研究では,HEK293細胞にAMPA受容体のサブユニットGluA2とその補助サブユニットTARP-γ2を融合させたタンパク質を発現させ,単離・精製してGluA2-γ2の可溶化試料を作成しました。その後,GluA2-γ2を脂質ナノディスクへ再構成することで,脂質二重膜内に埋め込まれた環境を再現し,0.3 秒の時間分解能で高速AFM観察を行いました。TARP-γ2との融合,脂質ナノディスクへの再構成,そして観察バッファーにフルオロ系界面活性剤を加える工夫により,GluA2-γ2のNTDのナノスケールでの動きを高速AFMで観察することができました。
高速AFMによる一分子イメージングにより,休止状態(リガンド非結合状態)とオープン/活性化状態(グルタミン酸結合状態)のGluA2-γ2のNTDが,脂質に対して水平方向に大きく揺れる動きをすることが明らかになりました(図2, 3)。具体的には,GluA2-γ2は四量体で構成され,その中の2つがペアとなりダイマー構造を作ります。このダイマー構造が2つ集まることで,GluA2-γ2四量体(ダイマーオブダイマー)を形成します。高速AFM動画では,脂質ナノディスクから突き出た2つのNTDダイマーが見えており,それらが互いに開閉する動きを示しました。過去のcryo-EM構造解析では,AMPA受容体のNTDは多様な構造をとり,クラス平均化が難しく,高い空間分解能での構造解析が困難とされています。高速AFMでは,室温下で溶液中のAMPA受容体一分子の動きを映し出していることから,NTDの大きな揺らぎ(フレームごとの多様な構造)が明確に観察でき,cryo-EMの解析結果と一致しています。
さらに,GluA2-γ2はオープン/活性化状態の後,リガンドが結合しているもののチャネルが閉じている脱感作状態へと移行します。この脱感作状態でのGluA2-γ2の動きを可視化するため,過去の論文に倣い,キスカル酸を観察バッファーに加えて高速AFM観察を行いました。その結果,2つのNTDダイマーが脂質に接近し,ダイマー間の距離が広がり,揺れが制限されてほとんど動かない構造をとることが分かりました(図4)。この構造は,過去に電子顕微鏡で報告されたものとよく似ていますが,揺らぎや動きが抑制されていることをはっきり示したのは高速AFMが初めてです。本研究グループは,GluA2-γ2のNTDダイマーが休止状態, オープン状態, 脱感作状態で大きく構造変化し,これがチャネルの開閉と連動していると考えています。
興味深いことに,高速AFMでGluA2-γ2を観察中に,時折,NTDダイマーが1つ(モノマー)に分かれたり,再び元のダイマーに戻ったりする様子が観察されました(図 5)。この「ダイマー分裂」現象は全ての状態で見られましたが,特に,オープン/活性化状態では,分裂している時間が長いことが分かりました。従来,AMPA受容体のNTDダイマーは非常に強固なものと考えられていましたが,溶液中のGluA2-γ2のNTDダイマーは,実際には,ダイマーとモノマーを遷移することが高速AFMによって明らかとなりました。さらに,分裂後のGluA2-γ2の四量体構造,および,NTDモノマー構造の安定性は,分子動力学(MD)シミュレーションを用いて確かめられました。
では,この「ダイマー分裂」はAMPA受容体にとってどのような機能を生み出すのでしょうか。本研究グループは,この「ダイマー分裂」がAMPA受容体のシナプス領域への集合に深く関与している可能性を考えました。これまでは,孤立した1つのGluA2-γ2を含む脂質ナノディスクの高速AFM観察を行っていましたが,複数のAMPA受容体が隣接している部分にも焦点を当てて高速AFM観察を行いました。その結果,近くに存在する2つのGluA2-γ2がそれぞれダイマー分裂を起こし,再び元のダイマーに戻る際に,もともとの四量体内で組み直すのではなく,隣のGluA2-γ2とサブユニットを交換して新たなダイマーを形成することが分かりました(NTDダイマー交換, 図6)。シナプス領域にはAMPA受容体が高濃度で存在することが過去の研究から示されており,そのためNTDダイマー交換が頻繁に起こりえる環境が整っているといえます。本研究で明らかとなった「ダイマー分裂」が引き金となり,NTDダイマーが交換されることで,他のAMPA受容体同士で手をつなぐように結びつき,結果的にAMPA受容体がシナプス領域に集まってとどまるというメカニズムが考えられます。
さらに,本研究グループはシナプス領域で分泌される神経ペントラキシン NP1というシナプスオーガナイザータンパク質にも注目しました。AlphaFold2を用いてGluA2-γ2とNP1の複合体を予測し,高速AFMでNP1の八量体構造とGluA2-γ2との結合を実際に可視化しました。興味深いことに,「ダイマー分裂」によってNP1とGluA2-γ2の間に,新しい結合部位が現れる可能性が示唆されました。GluA2-γ2がダイマーを形成している場合,この部位はサブユニット同士の結合面となるため,NP1が結合する余地はありません。しかし,「ダイマー分裂」によってモノマー化し,結合面が露出することで,新たな結合部位が出現します。高速AFM観察から,GluA2-γ2がグルタミン酸を結合したオープン/活性化状態では,モノマー状態が長く続くことが確認されました。これらを踏まえると,GluA2-γ2のNTDダイマーの分裂は,NP1との新しい結合部位を生み出し,シナプス領域での結合力を強化すると考えられます。しかし,さらなる検証実験が必要であり,GluA2-γ2とNP1,その他のシナプスオーガナイザータンパク質との結合様式や結合動態を今後も明らかにしていく必要があります。
本研究の結果をまとめると,高速AFMを用いたAMPA受容体一分子イメージングにより,異なるリガンド結合状態における脂質二重膜中のGluA2-γ2のNTDのナノ動態を直接可視化することに成功しました。特に,NTDの「ダイマー分裂」を発見し,AMPA受容体間のサブユニットが交換される様子を初めて可視化しました。さらに,NP1の八量体とAMPA受容体との結合様式,ダイマー分裂による結合親和性の向上の可能性も見出しました。これらの発見から,シナプス領域におけるAMPA受容体の集合を説明する新しい仮説を提唱しました(図7)。
今後の展開
AMPA受容体を介した神経伝達は,さまざまな脳の機能にとって非常に重要です。これまで,多くの研究が生化学的分析,構造生物学,動物実験といった手法で行われてきました。今回の高速AFMによるGluA2-γ2の一分子イメージングでは,溶液環境でGluA2-γ2のNTDがどのように動いて機能するかを直感的に理解する手助けを提供できたと考えています。このような分子のリアルな動きを可視化することは,例えばダイマー分裂を適切に制御する新しい治療薬の開発に新たな道を開くかもしれません。今後は,ダイマー分裂が細胞膜上で起こっているのか,他のシナプスオーガナイザータンパク質との結合,さらには,記憶や学習に関与する他のグルタミン酸受容体のナノ動態観察を通じて,記憶を分子レベルで解明していきたいと考えています。また,本研究で活用した高速AFMの手法は,他の真核生物の大きな細胞内外ドメインのナノ動態解析にも応用可能です。今後は,脂質二重膜から突き出たドメインのナノダイナミクスを基に,機能の解明がさらに進むことが期待されます。
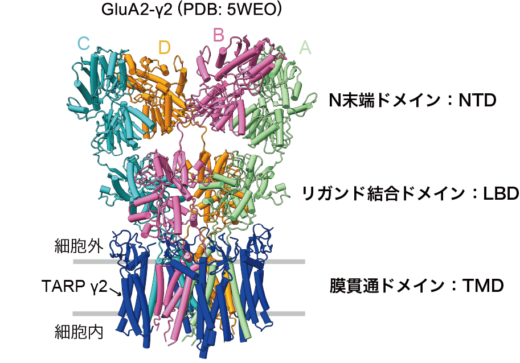
図1:GluA2-γ2の電子顕微鏡画像。A~Dの4つのサブユニットで構成される四量体で,AとB, CとDが二量体(ダイマー)ペアを形成する。

図2: 休止状態(リガンドが存在しない状態)で,脂質ナノディスクへ埋め込まれたGluA2-γ2の連続した高速AFM画像。右の画像は,NTDと脂質の軌跡を示す。以下の図2~6は,原著論文では動画を見ることができる。
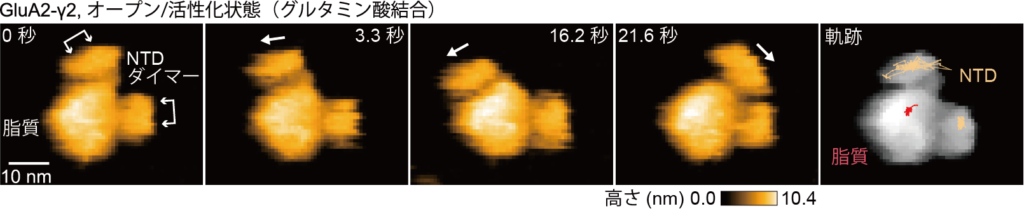
図3: オープン/活性化状態(グルタミン酸が存在する状態)で,脂質ナノディスクへ埋め込まれたGluA2-γ2の連続した高速AFM画像。右の画像は,NTDと脂質の軌跡を示す。
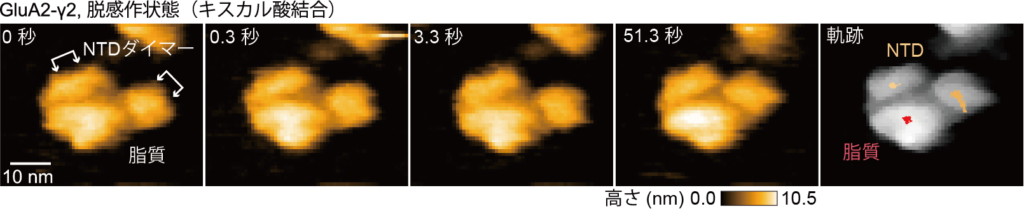
図4: 脱感作状態(キスカル酸が存在する状態)で,脂質ナノディスクへ埋め込まれたGluA2-γ2の連続した高速AFM画像。右の画像は,NTDと脂質の軌跡を示す。

図5:GluA2-γ2の「ダイマー分裂」を示す連続した高速AFM画像。

図6:「ダイマー分裂」により生じるNTDダイマー交換の瞬間を捉えた連続した高速AFM画像。
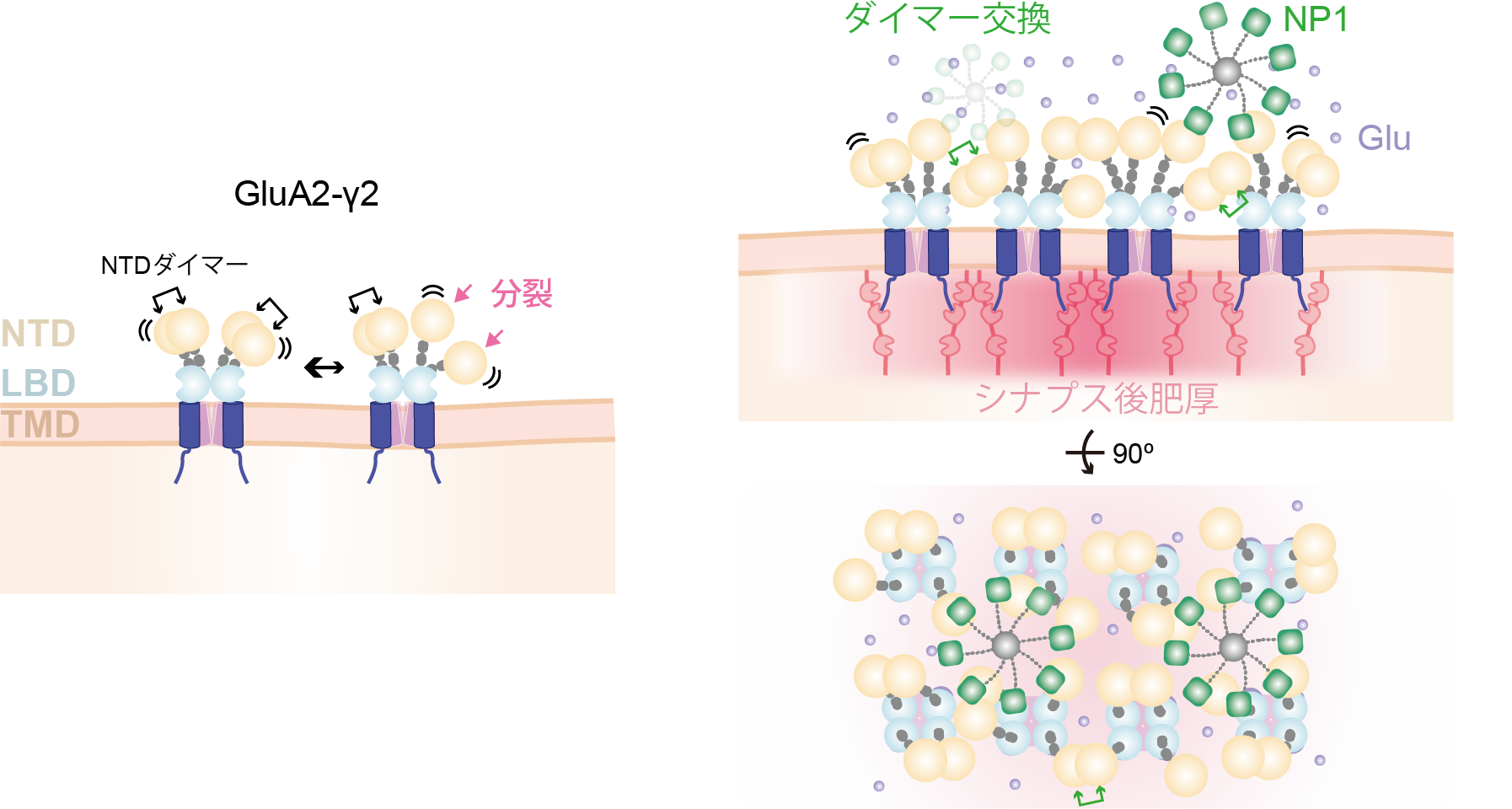
図7:高速AFM観察から明らかとなったNTDのナノダイナミクスに基づくAMPA受容体のシナプス領域での分子集合メカニズム。GluA2-γ2のNTDダイマーは大きく揺れ動き,ダイマー分裂が時折生じる。このダイマー分裂により(i)隣接するAMPA受容体とダイマーが交換される(ii)シナプスに分泌されるシナプスオーガナイザー分子NP1による橋渡し構造の形成やNTDとの親和力の増強といった,さまざまな作用が生じシナプス領域での集合が促進される。
用語解説
掲載論文情報
- 論文タイトル
- High-Speed Atomic Force Microscopy Reveals Fluctuations and Dimer Splitting of the N-Terminal Domain of GluA2 Ionotropic Glutamate Receptor-Auxiliary Subunit Complex (高速原子間力顕微鏡により明らかとなったAMPA型グルタミン酸受容体 GluA2-γ2のN末端ドメインのナノ動態とダイマー分裂)
- 著者
- Ayumi Sumino, Takashi Sumikama, Yimeng Zhao, Holger Flechsig, Kenichi Umeda, Noriyuki Kodera, Hiroki Konno, Motoyuki Hattori, Mikihiro Shibata (角野歩, 炭竈享司, イメン・チョウ, ホルガー・フレクシグ, 梅田健一, 古寺哲幸, 紺野宏記, 服部素之, 柴田幹大)
- 掲載誌
- ACS Nano
- 掲載日
- 2024.08.23
- DOI
- 10.1021/acsnano.4c06295
- URL
- https://pubs.acs.org/doi/10.1021/acsnano.4c06295

