肺がんに対する革新的な治療法を開発!
金沢大学がん進展制御研究所/ナノ生命科学研究所(WPI-NanoLSI)の福田康二助教,金沢大学附属病院腫瘍内科/ナノ生命科学研究所(WPI-NanoLSI)の竹内伸司講師,金沢大学附属病院呼吸器内科/ナノ生命科学研究所(WPI-NanoLSI)/がん進展制御研究所の矢野聖二教授らの研究グループは,KRAS(※1)遺伝子変異を持つ肺がん(KRAS肺がん)に対するWEE1(※2)タンパクを標的とした新しい治療法の開発に成功しました。
肺がんは日本で最も死亡率が高いがんであり,KRAS遺伝子変異は日本人肺腺がん患者さんの約10%に検出され,がんの発生や進展を強く促進する遺伝子異常であることが知られています。KRASを標的にした治療薬は長年開発が進みませんでしたが,最近日本でも,KRAS-G12C変異に特異的な阻害薬(KRAS-G12C阻害薬)が肺がんで承認されました。しかし,有効性が限定的で耐性が課題であり,より効果的な治療法の開発が切望されています。
本研究では,KRAS変異肺がんにおいて,746種類の遺伝子を実験的に破壊することで探索し,WEE1という分子を新しい治療標的として同定しました。さらに,本研究グループは,TP53というがん抑制遺伝子の変異も共存しているKRAS-G12C肺がんに対して,WEE1阻害薬とKRAS-G12C阻害薬を組み合わせることで,肺がん細胞をほぼ消失させる顕著な効果を確認し,非常に有望な治療であることを明らかにしました。
これらの知見は,KRAS阻害薬単独の有効性が限定的であるKRAS肺がんに,新たな治療選択肢を提供し,生存率の向上に貢献することが期待されます。
本研究成果は,2024年5月21日11時(米国東部標準時間)に国際学術誌 『Cell Reports Medicine』のオンライン版に掲載されました。
研究の背景
肺がんは,日本で最も死亡率が高いがんであり,KRAS遺伝子変異は日本人肺がん患者の約10%に検出され,そのうち約40%がKRAS-G12Cという変異型を有しています。KRAS遺伝子に変異を生じると細胞の制御不能な増殖を引き起こし,結果としてがんが発生します。これまでKRAS遺伝子変異を標的とした効果的な治療法は存在しませんでしたが,近年,KRAS-G12C阻害薬(ソトラシブ)が開発され,日本でも実臨床で使用されています。しかしながら,耐性が重大な課題であり,より効果的な治療法の開発が急務です。このような背景から,本研究ではKRAS遺伝子変異を持つ肺がん(KRAS肺がん)の細胞死を誘導できる新たな治療標的の探索を行いました。
研究成果の概要
本研究ではまず,KRAS肺がんにおいて,治療標的の網羅的なスクリーニングを実施しました。746種の遺伝子を実験的に破壊し,432種の薬剤を添加した結果,WEE1という分子がKRAS肺がん細胞の生存に極めて重要であることを明らかにしました。特に,がん抑制遺伝子であるTP53遺伝子の変異が共存していると,WEE1阻害によりKRAS肺がんの細胞死が顕著に誘導されました(図1)。

図1: 二つのKRAS肺がん細胞において746種類の網羅的な遺伝子破壊実験を行った結果,WEE1遺伝子の破壊が最も強くがん細胞の生存を阻害できることを示した。
WEE1はDNA修復経路(※3)に関与しており,がん細胞の異常な増殖によって発生したDNAの損傷を修復する時間を与えます。さらに,TP53遺伝子も変異しているとKRAS肺がん細胞の生存はWEE1に依存的になっています。本研究により,WEE1がCHK2という分子の発現を維持することによって,KRAS肺がん細胞が自身のDNAを修復して生存する過程に重要な役割を果たしていることを初めて明らかにしました。これにより,WEE1を阻害すると,KRAS肺がん細胞はDNAの損傷を回復できず細胞死に至ると考えられます。
さらに,WEE1阻害薬をKRAS-G12C阻害薬と併用することにより,KRAS-G12C肺がん細胞の増殖が抑制され,相乗的に細胞死の誘導が促進されることも明らかにしました。マウスを用いた実験では,WEE1阻害薬とKRAS-G12C阻害薬であるソトラシブを組み合わせた治療により,KRAS-G12C肺がん細胞を移植した皮下腫瘍に対して顕著な縮小効果を示し,治療中止後も腫瘍が再増大せず根治が示唆される個体も認めました。さらに,ソトラシブが無効であったKRAS-G12C変異肺がん患者さんのがん組織をマウスに移植したモデル(PDXモデル)での実験では,この二つの薬剤の併用により腫瘍がほぼ消失するという驚くべき結果が得られ,ソトラシブの効果が得られない患者さんに対しても有望な治療であることが示唆されました(図2,3)。

図2: KRAS-G12C変異を持つ肺がん患者のがん組織をマウスに移植したモデル(PDXモデル)での実験において,二つの薬剤の併用治療により腫瘍がほぼ消失する結果が得られた。
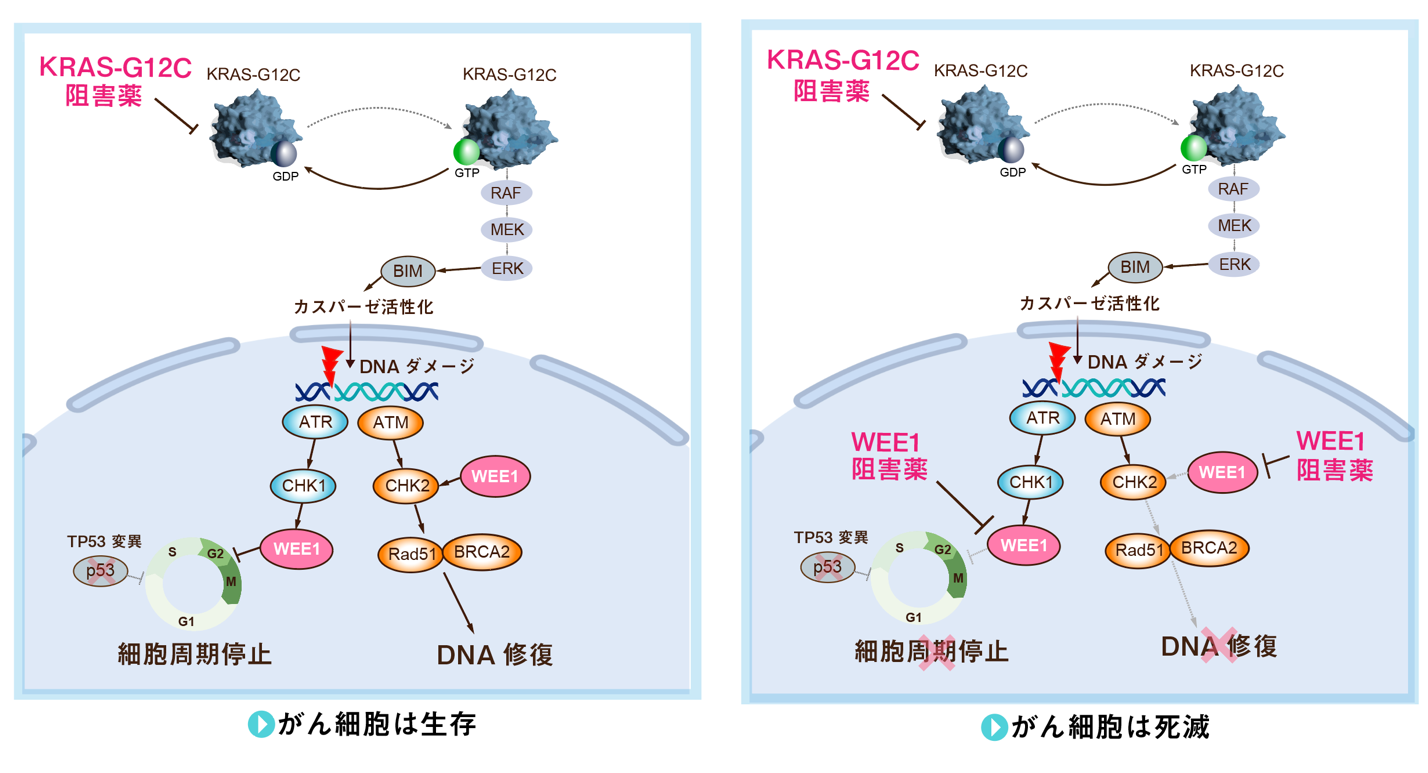
図3: 二つの薬剤によって肺がん細胞を死に至らせる仕組み。一つ目の薬(KRAS-G12C阻害薬)は,がん細胞のDNAにダメージを与える。しかし,がん細胞はWEE1を使ってこのダメージを修復し,生き延びることができる(左図)。そこで,二つ目の薬であるWEE1阻害薬を同時に使用することで,この修復プロセスを止め,結果的にがん細胞を死滅させることができる(右図)。
今後の展開
本研究で得られた成果に基づいて,KRAS-G12C阻害薬とWEE1阻害薬併用治療の有効性と安全性を評価する臨床試験につなげていきたいと考えています。
用語解説
掲載論文情報
- 論文タイトル
- Targeting WEE1 enhances the antitumor effect of KRAS-mutated non-small cell lung cancer harboring TP53 mutations (WEE1を標的とする治療はTP53変異を持つKRAS変異非小細胞肺がんの抗腫瘍効果を向上させる)
- 著者
- Koji Fukuda*, Shinji Takeuchi*, Sachiko Arai, Shigeki Nanjo, Shigeki Sato, Hiroshi Kotani, Kenji Kita, Akihiro Nishiyama, Hiroyuki Sakaguchi, Koshiro Ohtsubo, Seiji Yano (福田康二*,竹内伸司*,新井祥子,南條成輝,佐藤成樹,小谷浩,北賢治,西山明宏,坂口裕之,大坪公士郎,矢野聖二)
- 掲載誌
- Cell Reports Medicine
- 掲載日
- 2024.05.21
- DOI
- 10.1016/j.xcrm.2024.101578
- URL
- https://www.sciencedirect.com/science/article/pii/S2666379124002702?via%3Dihub

