多様なタンパク質の機能を制御するユビキチン化の 反応過程の映像化に成功!
金沢大学ナノ生命科学研究所(WPI-NanoLSI)の紺野宏記准教授,ホルガー・フレクシグ特任助教,金沢大学大学院自然科学研究科生命理工学専攻博士前期課程の武田春冴さん,金沢大学大学院自然科学研究科自然システム学専攻博士前期課程の室郁弥さん(研究当時)らの研究グループは,細胞内で営まれるほぼ全ての生命現象の制御を行うユビキチン化(※1)に関与している酵素の構造動態や,各種ユビキチン化関連酵素間で行われるユビキチン受け渡しの様子を,高速原子間力顕微鏡(高速AFM)(※2)を用いて,世界で初めて映像化することに成功しました。
タンパク質の翻訳後修飾の一つであるユビキチン化は,細胞内タンパク質の選択的分解,DNA修復,細胞周期,シグナル伝達,免疫など,多くの細胞内プロセスの制御に関与しています。そのため,ユビキチン化に関連した細胞機能調節システムの全貌解明は,基礎生物学的な観点だけでなく,医療への応用においても極めて重要です。ユビキチン化は,複数のユビキチン化関連酵素間でユビキチンを受け渡しながら進行します。これらの酵素の中で,ユビキチン連結酵素(E3)は,ユビキチン化すべき標的タンパク質に最終的にユビキチンを受け渡す酵素です。このE3に存在する,特定の構造を持たずふらふらと動く柔軟領域(ヒンジループ)を介した大きな構造変化が,ユビキチン受け渡しに必要であることがこれまで推測されていました。しかし,この構造動態を実際に観察した例がないため,長い間実証されていませんでした。今回の研究では,生体試料の形状と動きを同時に映像化できる高速AFMを用いて,E3の一つであるE6AP(※3)の部分構造体であるHECTドメイン(※4)の構造動態をリアルタイムで映像化しました。さらに,コンピューターシミュレーションによる解析結果も加え,E3の構造ダイナミクスや,その構造ダイナミクスにおけるヒンジプールの役割を詳細に理解することができました。これらの結果は,今後,ユビキチン化を通じたさまざまな細胞内プロセスの制御メカニズムに対して新しい知見を提供することが期待されます。
本研究成果は,2023年12月6日(米国東部時間)に国際学術誌『Nano Letters』のオンライン版に掲載されました。
研究の背景
ユビキチン化(標的タンパク質へのユビキチン付加)は,ユビキチン活性化酵素(E1),ユビキチン結合酵素(E2),ユビキチン連結酵素(E3)を含む一連の酵素間のユビキチンの受け渡しによって行われ,最終的に標的タンパク質にユビキチンを受け渡す役目は,E3が担っています(図1)。E3は,HECT型とRING型に大別されます。このうちHECT型E3の一つであるE6APの部分構造体(HECTドメイン)は,E2と相互作用する部位を含むN-ローブと,ユビキチンを受け取る際に必要なアミノ酸(システイン残基)を含むC-ローブから構成され,これらのローブは柔軟なヒンジループでつながっています。これらの構造的特徴から,柔軟なヒンジループを介したHECTドメインの大きな構造変化が,HECT型E3によるユビキチン受け渡しに必須であるという仮説が導かれています。しかし、1分子レベルにおける詳細な構造ダイナミクスは,明らかにされていませんでした。
研究成果の概要
本研究グループは,ユビキチン連結酵素(E3)の一つであるE6APの部分構造体(HECTドメイン)の構造変化過程を高速AFMを用いて映像化し,ユビキチン化に必須な各種酵素の構造変化や,集合・解離のダイナミクスを明らかにしました。
高速AFMを用いて,E6APのHECTドメインの構造動態を0.07秒/フレームの高時間分解能で映像化したところ,HECTドメインは球状と楕円状の異なる二つの形状を繰り返すことが分かりました(図2A)。次に,実際に観察されたAFM像と,これまでに知られている構造情報を基に,コンピューター上で疑似的に作成したAFM像(疑似AFM像)との比較から,球状はE2からE3にユビキチンが受け渡される際に必要な構造状態であること,楕円状はE3がユビキチンを受け取った後に標的タンパク質に受け渡す際に必要な構造状態であることが分かりました(図2B)。また,E2からE3にユビキチンが受け渡される一連の過程も,世界に先駆けて映像化することができました(図2C)。これらの構造状態の変化におけるヒンジループの役割を調べるために,ヒンジループの柔軟性を低減させたHECTドメイン(変異HECTドメイン)を,遺伝子操作技術を用いて人工的に作成し,その構造動態も観察しました。その結果,変異HECTドメインは,球状の構造状態しか取れないことが分かりました。今回の観察から,HECTドメインの構造変化におけるヒンジループの重要性を詳細な構造情報とともに理解することができました。
E6APのHECTドメインは,標的タンパク質にユビキチンを付加する機能のほかに,ユビキチンが二つ連結したユビキチン2量体を形成することも知られています。今回の高速AFM観察から,変異HECTドメインは,標的タンパク質にユビキチンを渡す構造は取れないが,E2からユビキチンを受け取ることができる構造状態であることが分かりました。つまり,変異HECTドメインは,ユビキチン2量体を形成する機能は保持している可能性が考えられました。そこで,変異HECTドメインの2量体形成能を生化学的研究手法により調べたところ,通常のHECTドメインに比べ,非常に多くのユビキチン2量体を形成することが分かりました(図3)。この結果から,ヒンジループの柔軟性は,ユビキチンの受け渡しだけでなく,ユビキチン2量体の形成効率にも大きく影響を与えることが分かりました。細胞内におけるユビキチン2量体の役割はまだよく分かっていませんが,最近その重要性を示唆する知見が増えてきています。例えば,ユビキチン2量体が細胞内タンパク質の分解装置として知られているプロテアソームに結合すると,その分解活性に影響を与えることが知られています。このことは,生体内に必要以上の過剰なユビキチン2量体が存在すると,細胞内タンパク質分解の恒常性が乱れる可能性を示唆しています。今回は,高速AFM観察,コンピューターシミュレーション,生化学的実験など,さまざまな実験手法の融合により,HECTドメインのヒンジループの役割を多角的に理解することができました。
今後の展開
E6APは,ヒトパピローマウイルス(HPV)由来のE6タンパク質と結合すると,がん抑制因子p53をユビキチン化してプロテアソームによるp53の分解を促進し,結果的に,p53の機能を喪失させることが知られています。また,E6APおよびE6によるp53のユビキチン化は,子宮頸がんの主要因であるとこも明らかになっています。しかし,E6AP/E6/p53複合体がどのように構築され,E6がどのようにE6APのユビキチン化活性を促進するかについては不明な点が多くあります。今後は,E6AP単体,E6AP/E6およびE6AP/E6/p53複合体の構造動態を解明し,E6がE6APによるp53ユビキチン化の活性を上昇させる仕組みを明らかにします。
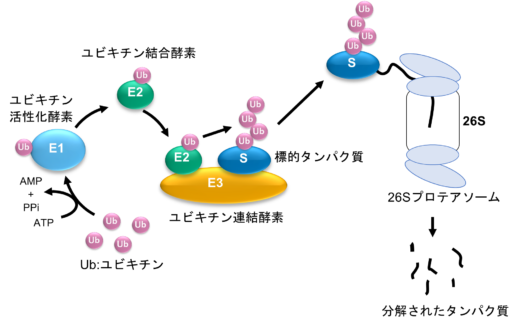
図1:タンパク質のユビキチン化およびユビキチン-プロテアソーム系によるタンパク質分解
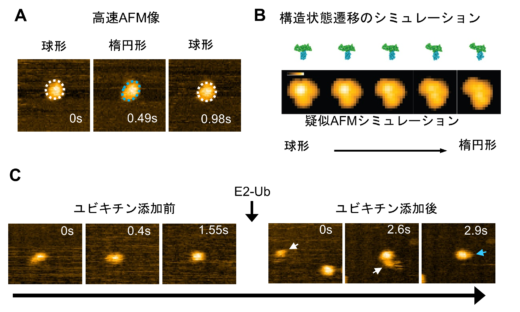
図2:E6APのHECTドメインの構造動態の高速AFM観察およびシミュレーション (A)HECTドメインの高速AFM像。球形(白点線)と楕円形(青点線)の構造状態を繰り返す様子が観察された。(B)シミュレーションによるHECTドメインの構造状態の遷移過程およびその際の疑似AFM像。(C)E2からE3(HECTドメイン)にユビキチン(Ub)が受け渡される様子。ユビキチンを保持したE2(E2-Ub)を添加後,E2-Ub(白矢印)がHECTドメインに結合し,E2が解離した後はHECTドメインにユビキチンと思われる小さい粒子(青矢印)が付加していた。
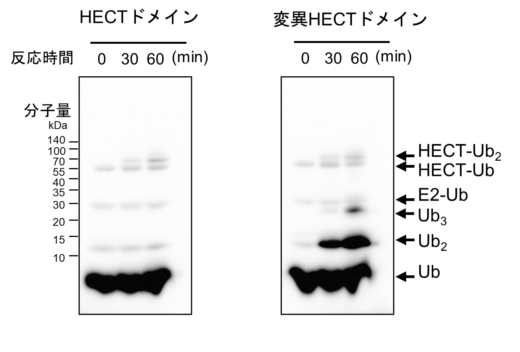
図3:通常のHECTドメインおよびヒンジループの柔軟性が欠失した変異HECTドメインにおけるユビキチン2量体(Ub2)の形成効率 ユビキチンの2量体(Ub2)形成効率は,ユビキチン特異的に反応する抗体を用いた免疫染色法により評価した。ユビキチンの量に依存してバンドの色が濃くなり,ユビキチンが連結する度合いよってバンドの位置が変わる。
用語解説
掲載論文情報
- 論文タイトル
- Structural dynamics of E6AP E3 ligase HECT domain and involvement of flexible hinge loop in ubiquitin chain synthesis mechanism (E6AP E3リガーゼHECTドメインの構造ダイナミクスと柔軟なヒンジループのユビキチン鎖合成機構への関与)
- 著者
- Kazusa Takeda,Holger Flechsig,Ikumi Muro,Romain Amyot,Fuminori Kobayashi,Noriyuki Kodera,Toshio Ando, and Hiroki Konno (武田春冴,ホルガー・フレクシグ,室郁哉,ロメン・アミヨ,小林史典,古寺哲幸,安藤敏夫,紺野宏記)
- 掲載誌
- Nano Letters
- 掲載日
- 2023.12.06
- DOI
- 10.1021/acs.nanolett.3c04150
- URL
- https://pubs.acs.org/doi/full/10.1021/acs.nanolett.3c04150

