世界初!高速原子間力顕微鏡で細胞外小胞の ナノ構造変化を捉えることに成功!
金沢大学大学院新学術創成研究科ナノ生命科学専攻博士後期課程3年のエルマ・サキナトゥス・サジダさん,ナノ生命科学研究所のキイシヤン・リン特任助教とナノ生命科学研究所/新学術創成研究機構のリチャード・ウォング教授らは,同ナノ生命科学研究所の華山力成教授,安藤敏夫特別功績教授らとの共同研究において,高速原子間力顕微鏡(高速AFM)(※1)を用いることで,物理化学的ストレスに対する細胞外小胞(※2)のナノ構造変化をリアルタイムかつ3Dで捉えることに世界で初めて成功しました。
細胞外小胞は,生体内でさまざまな脂質やタンパク質,核酸などの機能分子を運ぶことで,細胞間のコミュニケーションにおいて重要な役割を担っています。細胞外小胞はその性質から,バイオ医薬品として抗がん剤やワクチンなどへの応用が期待されています。従来,細胞外小胞の機能解析が世界中で活発に進められてきましたが,細胞外小胞は直径が100 ナノメートル前後と非常に小さいため,その構造の変化を直接リアルタイムで捉えることは困難でした。本研究では高速AFMを用いることにより,熱ストレス,pH,浸透圧などのさまざまな物理化学的ストレスに対する細胞外小胞のナノ構造変化をリアルタイムかつ3Dで捉えることに成功しました。その結果,高温,高pH,高浸透圧条件下では,細胞外小胞の構造は大きく変化しましたが,低pHや低浸透圧環境では,細胞外小胞は球形を保ったままであることが分かりました。このように,高速AFM はpHや浸透圧の変化に伴う細胞外小胞の不可逆的なナノ構造変化をリアルタイムで観察,評価することができる強力なツールであることが示されました。高速AFM は,高い時空間分解能(ナノ秒,ミリ秒レベル)で,定性的,定量的なデータを提供することができるため,将来,高速AFMが細胞外小胞のみならず,さまざまなナノ生体材料の評価ツールとして活用されることが期待されます。
本研究成果は,2022年11月1日(米国東部時間)に国際学術誌『Journal of Extracellular Vesicles』にオンライン掲載されました。
研究の背景
細胞外小胞は,脂質二重膜に包まれて細胞外へと放出される小胞の総称で,エンドソーム膜由来のエクソソーム,細胞膜由来のエクトソーム,死細胞膜由来のアポトーシス小体などが含まれます。細胞外小胞には,分泌細胞由来の脂質やタンパク質,核酸などの機能分子が含まれており,それを標的細胞へと受け渡すことで,さまざまな生理機能や疾患の発症を制御することが知られています。このことから細胞外小胞は,新たなバイオ医薬品として,ワクチンなどへの応用が可能なナノ生体材料であると期待されています。さらに,病的細胞由来の細胞外小胞では,これらの機能分子の組成が大きく異なることから,細胞外小胞は疾患の診断材料(バイオマーカー)としての活用が期待されており,細胞外小胞を構成する生化学的な分子組成だけではなく,細胞外小胞の物理的な特性評価も非常に重要です。従来の原子間力顕微鏡(AFM)でも,細胞外小胞のナノ構造変化を可視化し,その膜の硬さを測定することはできましたが,その画像は静的なスナップショットであるため,硬さの測定の時間分解能は低いと言わざるを得ず,ミリ秒単位での動的な変化をリアルタイムで観察・測定することは不可能でした。一方,本研究で用いた高速AFMは,高い時空間分解能を持つ強力なナノイメージングツールで,カンチレバーによってサンプルを穏やかにタッピングすることにより,試料にダメージを与えることなく,ミリ秒単位で画像を取得することができます。高速AFMを用いることで,ウォング教授らはこれまでに,ウイルスタンパク質,ヒストンへのDNAラッピング,真核生物のオルガネラ(核膜孔と細胞外小胞)のナノ構造変化を直接可視化してきました。
研究成果の概要
本研究では,温度,pH,浸透圧などさまざまな物理化学的ストレスに対する細胞外小胞のナノ構造の動的変化を明らかにしました。この結果は将来,細胞外小胞をバイオ医薬品として応用する際に,細胞外小胞の分離と品質管理において非常に重要なデータと成り得ます。一例として,陰イオン交換クロマトグラフィーを用いて細胞外小胞を迅速に分離・濃縮する際に,細胞外小胞は1M NaClといった高塩濃度にさらされますが,本結果により,このような方法で分離された細胞外小胞は本来の形とは異なってしまう可能性が考えられます。このように,ある種の分離技術は細胞外小胞の構造に影響を与える可能性があるため,高速AFMを用いて細胞外小胞の構造を確認することはその品質管理において有効と言えます。さらに,温度とpHは一般的な保存パラメータであることから,高速AFMは保存条件と細胞外小胞ナノ構造変化との関係を研究するのに適していることが示唆されました。例えば,熱安定性の高い細胞外小胞を用いてCOVID-19に対するワクチンを開発する際に,高速AFMを使用して品質管理を行うことにより,多くのワクチンがより多くの人へと届くようになります。
細胞外小胞は標的細胞においてエンドソームという膜に包まれて取り込まれ,その後エンドソーム内のpHが低下します。本研究では,この過程をバッファーのpHを7から4に変化させることで再現したところ,細胞外小胞のナノ構造変化は酸性条件に対して耐性があり,構造の変化がほとんど見られませんでした。エンドソーム内の低pH状態はいくつかのウイルス融合タンパク質にとって重要であり,細胞感染時にエンドソーム内へと取り込まれたウイルスが細胞内へと侵入するための膜融合の引き金となっています。ウォング教授らは以前,高速AFMを用いて,A型インフルエンザウイルスのヘマグルチニン融合タンパク質やSARS-CoV-2のスパイクタンパク質の細胞外小胞膜へのドッキング機構を明らかにしています。高速AFMを用いると,例えばヘリコバクター・ピロリが放出する細胞外小胞のナノ構造変化の動態を研究することもできます。ヘリコバクター・ピロリは,極端に酸性な環境でも生存でき,通常は胃酸を増加させるためにウレアーゼを分泌しています。ヘリコバクター・ピロリの細胞外小胞には,慢性胃炎や胃がんを誘発するがんタンパク質CagAやVacAが含まれており,胃がん患者では胃にヘリコバクター・ピロリ由来の細胞外小胞が蓄積されていることが報告されています。高速AFMを用いることで,これらの細胞外小胞のpH 依存的なナノ構造変化を調べ,その結果を慢性胃炎や胃がんの発症機構と関連づけることができるようになります。
これらの結果は,将来,細胞外小胞の機能解明や医療への応用に貴重な知見をもたらし,さまざまな細胞外小胞を用いた研究に貢献できるものと考えられます。
今後の展開
本手法を用いることで,細胞外小胞の pH依存的ナノ構造変化を高速AFMで調べ,慢性胃炎や胃癌の病態に関連付けることができます。現在,ウォング教授らは,低pHがエンドソームと細胞外小胞との膜融合を誘発し,これらの融合体が核内へ運ばれる前に核付近で細胞外小胞の内容物を放出している可能性を考え,このような細胞外小胞の非正規核輸送を追跡するために高速AFMイメージングを応用しようと試みています。この珍しい輸送経路が,細胞間コミュニケーションや,がん遺伝子/がんタンパク質,ウイルスタンパク質の核膜孔(※3)を介した輸送に必須であるかどうかを判断するために,さらなる検討を続けるとのことです。
研究資金
本研究は,武田科学振興財団ビジョナリーリサーチ助成(研究テーマ: 「新型コロナウイルスのタンパク質のナノ立体構造変換反応と構造創薬への開発」),文部科学省世界トップレベル研究拠点プログラム(WPI),日本学術振興会科学研究費助成事業(19K23841, 20K16262, 21H05744 , 21K19043 22H02209, 22H05537),JST CREST (No. JPMJCR18H4),小林国際奨学財団,島津科学技術振興財団,金沢大学新学術創成研究機構ユニット研究推進経費,金沢大学超然プロジェクト,金沢大学「新型コロナウイルス感染症対策支援ファンド」研究費の支援を受けて実施されました。
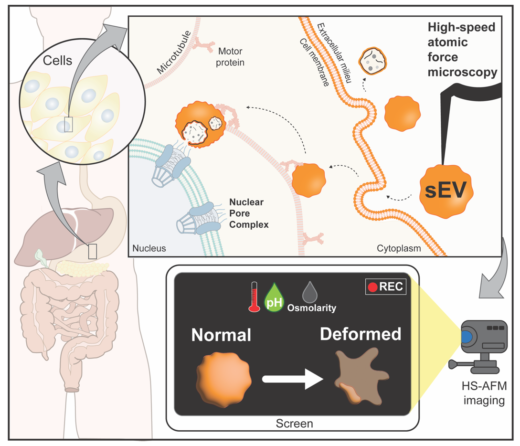
図1:生理的緩衝液中の細胞外小胞のネイティブなコンフォメーションをリアルタイムで可視化
(a) HEK293T細胞由来細胞外小胞のTIM-4アフィニティ精製を示すフローチャート。(b) 異なる条件下で細胞外小胞をイメージングするための高速AFMのセットアップを示す模式図。(c) 生理的環境下でのネイティブ(NEV)とホルマリン固定(FEV)細胞外小胞のナノ構造を示す高速AFM画像(スケールバー,NEV:18 nm; FEV:10 nm)。(d) NEVとFEVの立体構造。(e) NEVとFEVの高さを線グラフで示した。その結果,FEVではNEVに比べて高さの変動が少ないことから,ホルマリン固定によって細胞外小胞の剛性が向上することが分かった。©Elma Sajidah
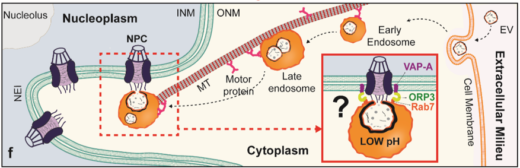
図2:新しい核輸送機構の発見
細胞外小胞内容物の核への輸送は,近い将来,高速AFMを用いて研究される可能性がある(AEC:陰イオン交換クロマトグラフィー,INM:内核膜,ONM:外核膜,NPC:核膜孔複合体,NEI:核膜侵襲,MT:微細管)。©Elma Sajidah
用語解説
掲載論文情報
- 論文タイトル
- Spatiotemporal tracking of small extracellular vesicle nanotopology in response to physicochemical stresses revealed by HS-AFM (高速AFMで明らかにした物理化学的ストレスに応答する細胞外小胞のナノトポロジーの時空間追跡 )
- 著者
Elma Sakinatus Sajidah1, Keesiang Lim2, Tomoyoshi Yamano2,4, Goro Nishide1, Yujia Qiu1, Takeshi Yoshida2, Hanbo Wang3, Akiko Kobayashi2,3, Masaharu Hazawa2,3, Forli R.P. Dewi3, Rikinari Hanayama2,4, Toshio Ando2, Richard W. Wong2,3 (エルマ・サキナトゥス・サジダ1,キイシヤン・リン2,山野友義2,4, 西出梧朗1, ユジア・チユ1,吉田孟史2,王瀚博3,小林亜紀子2,3, 羽澤勝治2,3,フイルリ・ラーマー・プリムラ・デウイ3,華山力成2,4,安藤敏夫2,リチャード・ウォング2,3)
- 金沢大学大学院新学術創成研究科ナノ生命科学専攻博士後期課程
- 金沢大学ナノ生命科学研究所
- 金沢大学新学術創成研究機構
- 金沢大学医薬保健研究域医学系
- 掲載誌
- Journal of Extracellular Vesicles
- 掲載日
- 2022.11.01
- DOI
- 10.1002/jev2.12275
- URL
- https://onlinelibrary.wiley.com/doi/10.1002/jev2.12275

