化学固定剤によって形成される 細胞表面のナノスケールクラスターの観察に成功!~原子間力顕微鏡を用いた新たな高分解能生細胞膜観察技術を開発~
金沢大学ナノ生命科学研究所の市川壮彦特任助教,福間剛士教授,ナノ生命科学研究所/がん進展制御研究所の大島正伸教授らの共同研究グループは,一般的に細胞や組織を固定するために使用されている化学固定剤(以下固定剤)(※1)が細胞表面の膜タンパク質を凝集させて20 – 100ナノメートルのクラスターを形成することを原子間力顕微鏡(AFM)(※2)と新たな細胞表面観察技術を用いて明らかにしました。
固定剤は,生きている状態に近い状態で細胞や組織の構造を保持するために一般的に使用されている薬剤です。固定剤がタンパク質の架橋や凝集を起こすことを考えると,細胞表面である程度自由に動き回る膜タンパク質が固定剤により凝集しナノスケールの擬似的なクラスターを生じることで共局在解析等に影響を与える可能性が指摘されています。それにもかかわらず,この問題については,これまで細胞表面の構造をナノスケールで観察する方法がなかったためほとんど研究が行われていませんでした。本研究では,AFMと多孔窒化シリコン薄膜(※3)を用いて,細胞表面を安定かつ高分解能で観察する方法を開発しました。そして,一般的に用いられる3種類の固定剤で処理するといずれも細胞表面の突起の大きさが増大することを示し,これらの突起サイズの増加は固定剤による膜タンパク質の凝集によって生じたものであることを明らかにしました。
これらの知見は,固定剤を用いて固定された細胞表面をナノスケールで観察する今後の研究に注意を喚起するものになります。
本研究成果は,2022年5月20日午前10時(英国時間)に英国科学誌『Communications Biology』に掲載されました。
研究の背景
細胞や組織の固定は,形態観察や免疫染色などを行うためにまず始めに行なわれる処理であり,これまでにも数多くの研究でこの方法が用いられています。一般に用いられる固定剤のうち,パラホルムアルデヒドやグルタルアルデヒドなどのアルデヒド系固定剤は隣接するタンパク質間に架橋を形成し,メタノールなどのアルコール系固定剤は脱水により分子を凝集します。このようなメカニズムから,細胞膜上をある程度自由に動く膜タンパク質が固定剤によって凝集することによって擬似的なクラスターを形成する可能性が予想されていました。これまでの研究により,固定剤が細胞表面構造の一部を数百ナノメートルから数ミクロンのスケールで変化させることは報告されてきましたが,数ナノメートルの分解能で固定剤の影響について調べた報告はありませんでした。
細胞表面の観察はこれまで主に光学顕微鏡や電子顕微鏡を用いて行われてきました。光学顕微鏡は生きた細胞を観察することが可能ですが,回折限界のため分解能は200ナノメートル以上になります。一方,電子顕微鏡は1ナノメートル以下の高い分解能を持ちますが,生きた試料を観察することはできません。そこで私達の研究グループでは,高い分解能を持ち,かつ生きた細胞を観察可能なAFMを用いることにしました。ところが,AFMは硬い表面では1ナノメートル以下の分解能を持ちますが,生きた哺乳類細胞は表面が柔らかく揺らぎやすいためその表面を数ナノスケールの分解能で観察することは困難でした。
研究成果の概要
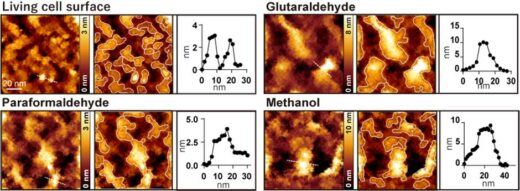
本研究グループは,透過型電子顕微鏡のサンプルホルダーとして用いられている多孔窒化シリコン薄膜を用いて,観察領域以外の領域を硬い膜で支持することにより生きた哺乳類細胞表面を数ナノメートルの分解能で観察する技術の開発に成功しました(図1)。この方法を用いて生きた大腸がん細胞の表面を観察したところ,直径10ナノメートル以下の1分子に相当する大きさの構造体を安定的に観察することができることが分かりました(図2生細胞)。そして,パラホルムアルデヒド,グルタルアルデヒド,メタノールといった一般的に用いられている固定剤で細胞を処理すると,生きた細胞では見られた小さな構造体が無くなり,直径20 – 100ナノメートル程度の大きな突起のみが観察されました(図2)。さらにこの突起の形成過程を観察するために2種類の相互作用しない膜タンパク質を蛍光標識し蛍光顕微鏡で観察中に固定剤を投入したところ,2種類の膜タンパク質が凝集する様子が観察されました。また,超解像顕微鏡で観察した膜タンパク質の局在がAFM像における大きな突起と概ね対応していることから,固定後に見られた大きな突起は固定剤によって膜タンパク質が凝集したものであることが示されました。
今後の展開
本研究で開発した生細胞膜の高分解能観察技術により他のさまざまな条件でのナノスケールの細胞膜への影響を調べることが可能になります。また,本研究で示されたように,膜タンパク質の局在をナノスケールで調べる研究者にとって,細胞表面で観察される膜タンパク質のクラスターが人工的に形成されたものである可能性への検討を促すことに繋がると期待されます。
研究資金
本研究は,文部科学省世界トップレベル研究拠点プログラム(WPI),日本学術振興会科学研究費助成事業(基盤研究(A),20H00345及び19K22125, 基盤研究(C), 19K06580),科学技術振興機構未来社会創造事業(18077272)の支援を受けて実施されました。
*∵*∴*∵*∴*∵*∴*∵*∴*∵*
図1.多孔窒化シリコン薄膜を用いた新しいAFM用生細胞膜観察技術。(a)多孔窒化シリコン薄膜の外観。(b)AFMで観察した多孔窒化シリコン薄膜。(c)観察用チャンバーにセットした時の様子。(d)多孔窒化シリコン薄膜を用いたAFM細胞表面観察の模式図。
図2.生細胞及びグルタルアルデヒド,パラホルムアルデヒド,メタノールでそれぞれ処理した後のAFM細胞表面の観察。それぞれ左がAFM像,中央はAFM像に突起部分を枠で囲んだ図,右は左図の点線部分に沿った高さのプロファイル。
用語解説
掲載論文情報
- 論文タイトル
- Chemical fixation creates nanoscale clusters on the cell surface by aggregating membrane proteins (化学固定は膜タンパク質を凝集することによって細胞表面にナノスケールのクラスターを形成する)
- 著者
- Takehiko Ichikawa, Dong Wang, Keisuke Miyazawa, Kazuki Miyata, Masanobu Oshima, Takeshi Fukuma (市川 壮彦,Dong Wang,宮澤 佳甫,宮田 一輝,大島 正伸,福間 剛士)
- 掲載誌
- Communications Biology
- 掲載日
- 2022.05.20
- DOI
- 10.1038/s42003-022-03437-2
- URL
- https://www.nature.com/articles/s42003-022-03437-2