時計タンパク質KaiCのリン酸化の概日リズムを安定化するメカニズム
要旨
金沢大学新学術創成研究機構ナノ生命科学研究所の安藤敏夫特任教授は、名古屋大学、米国のバンダービルト大学とスプリングヒル大学と共同で、高速AFMと計算機シミュレーションを用いて、シアノバクテリアの時計タンパク質の概日リズムを安定化するメカニズムを世界で初めて解明しました。概日時計タンパク質KaiA, KaiB, KaiCは、数日に亘って細胞内で持続するKaiCのリン酸化の約24時間周期の振動を試験管内で再現します。KaiAがKaiCに短時間で頻繁に相互作用し、それによりKaiCの自己リン酸化活性が増大するとともに、そのリン酸化の増大に連れてKaiAのKaiCへの親和性が低下して行く様子が観察されました。すなわち、KaiCのリン酸化状態がKaiAの結合イベントにフィードバックされることが分かりました。この頻繁に起こる短時間の結合・解離が長時間の振動周期を決定するだけでなく、親和性の変化はノイズのある細胞内環境での概日振動に安定性を与えることが見出されました。
概日リズムとは生体に内在する生化学的なペースメーカー(生物時計)により制御される約24時間の振動を示す生物学的な一連の変化です。これら変化は遺伝子発現、代謝、細胞分裂から発達、行動にまで及びます。不思議なことに、この変化のリズムは生物時計に影響を与える細胞内の成分が変動しても安定に保たれます。実際、一日当たり数分の狂いしか生じません。シアノバクテリアの生物時計はKaiA, KaiB, KaiCと呼ばれるタンパク質からなり、KaiCの自己リン酸化の程度が約24時間のリズムを刻みます。細胞から取り出して精製したKaiABC複合体でもリン酸化・脱リン酸化反応は概日リズムを示します。本研究で我々は、KaiABC複合体におけるKaiCのリン酸化の概日リズムがタンパク質濃度の変動に対しても安定に維持される仕組みを探りました。
KaiCは図1a,bに示すように、N端側のCIリングとC端側のCIIリングが重なったような六量体のリングを形成します。CIIリングには触手のような毛が生えており、そこにKaiA二量体が結合します。CIIリングには1プロトマー当たりKaiCの自己キナーゼ活性によりリン酸化されるアミノ酸が二カ所(S431とT432)あり、リン酸化を”p”で表わすと、リン酸化・脱リン酸化が約24時間かけて
S/T → S/pT → pS/pT → pS/T → S/T
のように進行することが知られています(図1c)。そこで、これら4つのリン酸化状態を模擬する変異体KaiC-AA(S/Tに対応)、KaiC-AE(S/pTに対応)、KaiC-DE(pS/pTに対応)、KaiC-DA(pS/Tに対応)をCIIリングが上になるようにアミノシランでコートされたマイカ基板(AP-mica)に固定し、外液にKaiAを1μM加えて高速AFM観察しました。その結果、KaiC-AA, KaiC-AE, KaiC-DA, KaiC-DEの順にKaiAのKaiCへの親和性が低下していくことが分かりました(図1d)。最も親和性が強いKaiC-AAでは、一旦KaiAが結合すると結合寿命の見積もりが困難になるほど長時間結合し、その一方、最も親和性の弱いKaiC-DEでは0.26秒で解離することが分かりました。野生型での高速AFM観察は丸二日間の昼夜連続実験を強いられましたが、図2に示すように、KaiAの結合寿命がKaiCのリン酸化の程度に同期して約24時間周期で変動することが分かりました(リン酸化量が増えるとKaiAの結合寿命は短くなる)。この現象をPhosphoform-Dependent Differential Affinity of KaiA for KaiC (PDDA)と名付けました。PDDA効果は、KaiAのKaiCへの結合によって加速されるKaiCのリン酸化が、KaiAのKaiCへの結合を抑制する方向にフィードバックされることを意味します。従って、PDDA効果はリン酸化の周期的な変動を生み出す原動力のひとつと考えられます。また、一日当たり10万回程度の頻度で起こる短時間(おおよそ1秒)のKaiAとKaiCのダイナミックな結合・解離が24時間という長い時間で起こるKaiCのリン酸化・脱リン酸化を制御していることになります。
次に、KaiCのリン酸化の概日振動の安定性にPDDA効果がどのように効くかを調べました。KaiCのリン酸化の程度を85時間に亘り測定しました。この測定では、32時間目のタイミングでKaiC六量体に対するKaiA二量体の割合(R)をKaiAを様々な濃度で加えることによりR = 1.13から急激に増大させました。その結果、1.13 < R < 3.0の範囲で約24時間の周期がほぼ維持されることが分かりました(図3a)。この実験結果はコンピューターシミュレーションでも確認されました(図3bの色付き線、及び、図3cの赤線)。次に、PDDA効果を取り除いてシミュレーションしたところ(図3bの黒線)、KaiCのリン酸化状態の振動の周期はR = 2.0から長くなり始め、R = 2.5では振動が完全に消失しました(Fig. 3cの 黒線)。こうして、高速AFM観察で発見されたPDDA効果が概日周期の安定性に大きく寄与していることが明らかになりました。
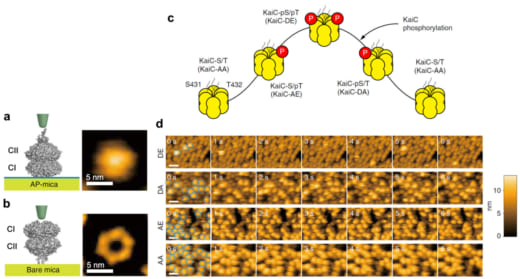
図1. 基板に載せたKaiCの模式図とAFM像、及び、KaiCのリン酸化に依存したKaiAのKaiCへの結合.
(a) アミノシランでコートしたマイカ(AP-mica)に載せたKaiCの模式図(左)とAFM像(右).
(b) 無処理のマイカ(Bare mica)に載せたKaiCの模式図(左)とAFM像(右).CIIリング側に触手様の構造があるため、AP-micaに載せた場合のAFM像では中心孔が見えない.
(c) KaiCのリン酸化状態の概日サイクル.
(d) KaiCのリン酸化状態を模擬した4種の変異体をAP-micaに載せ、1 μMのKaiAを溶液に加えたときの高速AFM像.イメージング速度:1 フレーム/秒.スケールバー:20 nm.
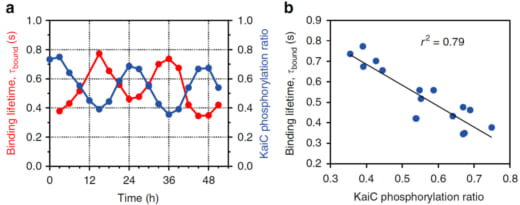
図2. 野生型のKaiCのリン酸化の程度に同期して変動するKaiAの結合寿命.
(a) 51時間に亘るKaiABCシステムにおけるKaiCのリン酸化の割合とKaiAの結合寿命の経時変化.
(b) KaiCのリン酸化の程度とKaiAの結合寿命の相関.
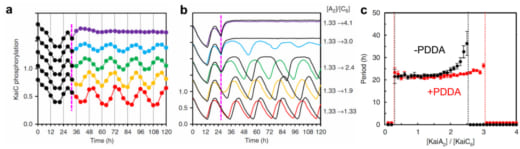
図3. 概日サイクル中にあるKaiABC複合体において、27時間目にKaiAの濃度を急激に変えたときのKaiCのリン酸化の変動リズム.(b)の右に示す数値は、KaiC六量体の濃度に対するKaiA二量体の濃度比を1.33から変化させた数値を示す.
(a) 野生型のKaiABC系で得られた実験結果.
(b) (a)の実験に対応するシミュレーションの結果.色付きの線はPDDA効果の有る場合、黒線は無い場合を示す.
(c) PDDA効果の有る場合と無い場合のKaiCのリン酸化の振動周期のシミュレーション結果をKaiC六量体に対するKaiA二量体の濃度比の関数として表わした図.
掲載論文情報
- 論文タイトル
- Revealing circadian mechanisms of integration and resilience by visualizing clock proteins working in real time
- 著者
- Tetsuya Mori , Shogo Sugiyama, Mark Byrne, Carl Hirschie Johnson, Takayuki Uchihashi, Toshio Ando
- 掲載誌
- Nature Communications
- 掲載日
- 2018.08.14
- DOI
- 10.1038/s41467-018-05438-4
- URL
- http://doi.org/10.1038/s41467-018-05438-4

